题目内容
4.设NA表示阿伏加德罗常数,下列叙述正确的是( )| A. | 一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2 NA | |
| B. | 1 mol AlCl3在熔融状态时离子总数为0.4NA | |
| C. | 标况下,11.2 L氯气完全溶于1 L水中,所得溶液中Cl-和ClO-两种粒子数之和为NA | |
| D. | 6.4 g由S2、S4、S8组成的混合物含硫原子数为0.2 NA |
分析 A、二氧化硫与氧气生成三氧化硫的反应为可逆反应,反应物不可能完全转化成生成物;
B、氯化铝为共价化合物;
C、氯气与水反应是可逆反应,不可能反应完全;
D、S2、S4、S8都是与S原子构成的,6.4g混合物中含有6.4gS原子,含有0.2mol硫原子;
解答 解:A、6.4g二氧化硫的物质的量为0.1mol,由于二氧化硫转化成 三氧化硫的反应为可逆反应,则反应生成的三氧化硫小于0.1mol,转移的电子小于0.2mol,故A错误;
B、氯化铝为共价化合物,在熔融状态下以分子形式存在,不能电离为离子,故B错误;
C、氯气与水反应是可逆反应,不可能反应完全,所得溶液中Cl-和ClO-两种粒子数之和小于NA,故C错误;
D、6.4gS2、S4、S8的混合物中含有6.4gS原子,含有0.2mol硫原子,所含S原子数为0.2NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
12.氯酸是一种强酸,常温下浓度超过40%时会发生分解,反应可表示为:aHClO3→bO2↑+cCl2↑+dHClO4+eH2O,用湿润的淀粉碘化钾试纸检验气体产物时,试纸先变蓝后褪色.下列说法正确的是( )
| A. | 由反应可知化学计量数存在如下关系:2b=5c+d | |
| B. | 若化学计量数a=8,b=3,则电子数转移为20e- | |
| C. | 若氯酸分解所得的lmol混合气体质量为47.6g,则反应方程式可表示为:26HClO3→15O2↑+8C12↑+10HClO4+8H2O | |
| D. | 变蓝的淀粉碘化钾试纸褪色是因为漂白 |
19.下列关于某些电解质溶液的判断中,正确的是( )
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
9.下列叙述不正确的是( )
| A. | 因为氯气具有酸性,所以可与烧碱或石灰乳反应制备含氯消毒剂 | |
| B. | 除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤、分液 | |
| C. | 过氧化钠中含有离子键和非极性共价键,阴离子与阳离子的物质的量之比为1:2 | |
| D. | 植物油的不饱和程度高于动物油,植物油更易氧化变质 |
13.以NA表示阿佛加德罗常数,下列说法中正确的是( )
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
11.下列实验方案中,不能达到实验目的是( )
| 选项 | 实验目的 | 实验方案 |
| A | 检验淀粉是否水解生成葡萄糖 | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后水解液用NaOH溶液中和,然后再加入新制Cu(OH)2浊液,加热,观察是否有红色沉淀生成 |
| B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀硫酸后,滴加KSCN溶液,观察溶液是否变红 |
| C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4,振荡,静置,可观察到下层液体呈紫色 |
| D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
 2H2(g)+S2(g)△H
2H2(g)+S2(g)△H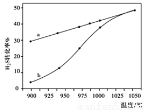
 应制取H2,反应方程式如下:
应制取H2,反应方程式如下: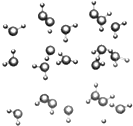 信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):
信息:在20℃、1个大气压下,水可以结成冰,称为“热冰”(如图):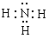 .
.