题目内容
14.化学与生产、生活密切相关.下列说法中正确的一项是( )| A. | PM2.5(直径小于或者等于2.5×10-6m的细颗粒物)分散在空气中形成的溶胶 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 自来水厂可使用Cl2和绿矾(FeSO4•7H2O) 进行自来水的消毒、净化,以改善水质 | |
| D. | 在食品包装袋中放入装有硅胶的透气小袋,可以防止食物氧化变质 |
分析 A、胶体的分散系中分散质的直径在1~100nm;
B、根据聚酯纤维和光导纤维的成分分析;
C、根据Cl2具有强氧化性,Fe3+水解生成Fe(OH)3胶体具有吸附性;
D、硅胶具有吸水性,铁具有还原性.
解答 解:A、胶体的分散系中分散质的直径在1~100nm,PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,直径大于100nm,则细颗粒物分散在空气中形成的分散系不是胶体,故A错误;
B、因制作航天服的聚酯纤维属于有机物,故B错误;
C、Cl2具有强氧化性,可对水进行消毒,又会将Fe2+氧化为Fe3+,Fe3+发生水解生成Fe(OH)3胶体,吸附悬浮物而净化水,故C正确;
D、硅胶具有吸水性,则在盛放食品的包装袋中放入盛有硅胶的透气小袋,可防止食物受潮,故D错误;
故选C.
点评 本题结合生活生产科研问题考查了氧化性、吸附性、胶体的概念等基础知识,综合考查元素化合物知识与化学反应原理,题目难度不大.

练习册系列答案
相关题目
5.卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们.

(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)

(1)卤族元素位于元素周期表的p区;溴的价电子排布式为4s24p5.
(2)测定液态氟化氢的相对分子质量,实验值大于20,原因是存在因氢键形成的缔合分子(HF)n.
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是碘(写出名称).
| 氟 | 氯 | 溴 | 碘 | |
| 第一电离能(kJ/mol) | 1681 | 1251 | 1140 | 1008 |
请比较二者酸性强弱:HIO3>H5IO6(填“>”、“<”或“=”),原因是碘酸中非羟基氧原子数多,其正电性更高,导致I-O-H中O的电子更向I偏移,越易电离出氢离子,酸性强于高碘酸
(5)BCl3是一种非金属氯化物,其分子中B-Cl键的键角为120°,写出一种与BCl3互为等电子体的离子CO32-.
(6)如图3为碘晶体晶胞结构.有关说法中正确的是.
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(如图4)的密度为pg/cm3,NA为阿伏伽德罗常数.
①阳离子的配位数为8.
②晶胞边长a=$\root{3}{\frac{312}{ρ•{N}_{A}}}$cm(用含p、NA的代数式表示)
9.下列反应与4H2O2+PbS→PbSO4+4H2O相比较,H2O2的作用相同的是( )
| A. | H2O2+SO2→H2SO4 | |
| B. | 3H2O2+2NaCrO2+2NaOH→2Na2CrO4+4H2O | |
| C. | 2H2O2→2H2O+O2↑ | |
| D. | H2O2+2FeCl3→2FeCl2+2HCl+O2↑ |
19.下列关于某些电解质溶液的判断中,正确的是( )
| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
2.下列化合物中互为同系物的醇类是( )
| A. | CH3CH2OH与CH2=CHCH2OH | |
| B. | CH3OH与HO-CH2-CH2-OH | |
| C. | HO-CH2-CH2-OH与HO-CH2-CH2-CH2-OH | |
| D. |  与 与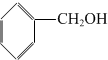 |
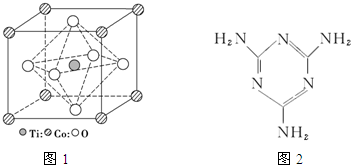 MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能.
MnO2是碱锰电池材料中最普通的正极材料之一,在活性材料MnO2中加入CoTiO3纳米粉体,可以提高其利用率,优化碱锰电池的性能. 有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题:
有A、B、C、D、E、F、G、H八种原子序数依次增大的元素(原子序数均小于30).A原子的核外电子数与电子层数相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,A、E同主族,F的基态原子s能级的电子总数与p能级的电子数相等,B、G同族,H的基态原子的3d轨道电子数是4s电子数的4倍.请回答下列问题: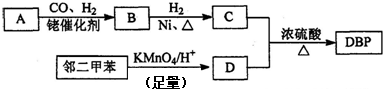
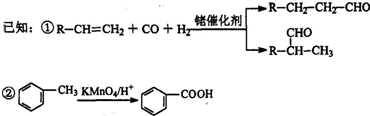


 .
.