题目内容
8.图一为某套实验装置示意图,其中加热装置和部分药品等均已经省略(装置①和装置②为气体发生装置).(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)制备NO2并验证其性质.装置①用于实验室制备NH3,用装置②制备过量O2.装置①中发生反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,请解释原因A中产生了NO,2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅.
(2)乙同学用此套装置合成SO3,B处冰水冷却的U型管中有固体出现.C中若盛放酸性K2Cr2O7溶液,则在C中发生的氧化还原反应的离子方程式是Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O(生成物中Cr以Cr3+形式存在);现欲制得纯净干燥的SO3,若C中盛放NaOH溶液,则此装置中存在明显不足,应如何改进
将e、m依次连接在B、C之间或将C装置换成f(从图二给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置).
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置①、装置②分别制NO和NH3),将图一装置A、B、C分别换成下列⑤、⑥、⑦如图三所示.
请回答:装置⑦的作用可能是吸收未反应的NO;若进入装置⑤的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到标准状况下11.2LN2,则NO的转化率是60%.

分析 (1)装置①用于实验室制备NH3,铵盐与碱加热制备;一氧化氮易被氧气氧化成红棕色的二氧化氮,所以B处冰水冷却的U型管中有红棕色气体生成,二氧化氮中存在一个平衡,会转化为无色的四氧化二氮,温度降低,平衡向正反应方向移动,所以U型管底部颜色越浅;
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,据此书写化学方程式;欲制得纯净干燥的SO3,若C中盛放NaOH溶液需将C装置换成f,或将e、m依次连接在B、C之间;
(3)硫酸亚铁吸收NO,Fe2++NO=Fe(NO)2+生成配合物;根据反应6NO+4NH3═5N2+6H2O计算NO的转化率.
解答 解:(1)装置①用于实验室制备NH3,化学反应为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;B处冰水冷却的U型管中有红棕色气体生成且越接近U型管底部颜色越浅,是因为A中产生了NO,2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;A中产生了NO,2NO+O2=2NO2,2NO2(红棕)?N2O4(无色),正反应是放热反应,U型管底部的温度降低,上述平衡向右移动,NO2浓度降低,颜色变浅;
(2)K2Cr2O7中的铬为+6价具有强氧化性,二氧化硫中的硫为+4价的硫具有还原性,发生氧化还原反应,+6铬变为产物中的+3价铬,二氧化硫中+4价的硫变为产物中+6价的硫,反应的离子方程式为Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O,欲制得纯净干燥的SO3,需用浓硫酸干燥需选e,不能选f,然后用m收集,将e、m依次连接在B、C之间或将C装置换成f,
故答案为:Cr2O72-+3SO2+2H+=2Cr3++3SO42-+H2O;将e、m依次连接在B、C之间或将C装置换成f;
(3)装置①、装置②分别制NO和NH3,在⑤中二者发生氧化还原反应生成氮气,可能混有NO或氨气,⑥可吸收水或氨气,因一氧化氮与二价铁形成配位键,溶液中淡绿色的二价铁变成棕色的一氧化氮配合物,反应为FeSO4+NO=Fe(NO)SO4,装置⑦的作用吸收未反应的NO;
在一定条件下反应中气体的体积之比等于物质的量之比,
6NO+4NH3═5N2+6H2O
6 5
V 11.2L
$\frac{6}{5}=\frac{V}{11.2}$,解得V=13.44L,则NO的转化率为$\frac{13.44L}{22.4L}$×100%=60%,
故答案为:吸收未反应的NO; 60%.
点评 本题考查性质实验方案的设计,为高频考点,把握反应原理、实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大,注意常见气体的制备及性质.

| A. | 0.1mol/LNaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| B. | 等浓度等体积的Na2CO3溶液与NaClO溶液混合后:2c(Na+)=3c(ClO-)+3c(HClO)+3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| C. | 室温下,KOH与苯酚混合pH=7的溶液中:c(K+)>c(C6H5O-)>c(H+)=c(OH-) | |
| D. | 某温度下,水的离子积常数Kw=10-13,在此温度下,将pH=12的NaOH溶液Va L与pH=2的硫酸Vb L混合,所得溶液呈中性,则Va:Vb=10:1 |
| A. | 8gCH 4中含有的共价键总数为NA | |
| B. | 3.2g的Cu与足量的浓HNO3反应生成的气体分子数为NA | |
| C. | 含有NA个中子的D2O的质量为2.0g | |
| D. | PH=2的硫酸氢钠溶液中的硫酸根离子数为0.01NA |
| A. | 亚硫酸钠溶液加入稀硝酸:SO32-+2H+=SO2↑+H2O | |
| B. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ | |
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:H++SO42-+Ba2++OH-=BaSO4↓+H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
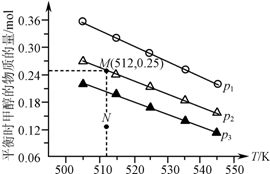 在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )
在1.0L恒容密闭容器中投入1mol CO2和2.75mol H2发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g),实验测得不同温度及压强下,平衡时甲醇的物质的量变化如图所示.下列说法正确的是( )| A. | 该反应的正反应为放热反应 | |
| B. | 压强大小关系为p1<p2<p3 | |
| C. | M点对应的平衡常数K的值约为1.04×10-2 | |
| D. | 在p2及512 K时,图中N点v(正)<v(逆) |

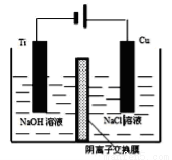
 △H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
△H>0,水蒸气的浓度(mol/L)随时间t(min)变化如下表所示:
 .
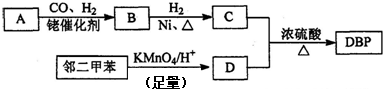
.
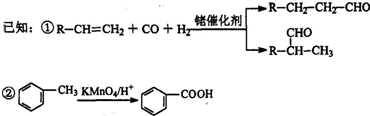


 .
.