题目内容
11.某元素原子最外层只有1个电子,它跟氯元素相结合时,所形成的化学键是( )| A. | 一定是共价键 | B. | 一定是离子键 | ||
| C. | 可能是共价键,也可能是离子键 | D. | 可能不形成化学键 |
分析 某元素原子最外层只有1个电子,该元素可能为金属元素,如碱金属元素、第IB族、第VIB族元素,可能是非金属元素,如H元素,以此解答该题.
解答 解:某元素原子最外层只有1个电子,该元素可能为金属元素,如碱金属元素、第IB族、第VIB族元素,可能是非金属元素,如H元素,与卤素相结合时,如果结合生成HCl,则只含共价键,如果结合生成NaCl等,只含离子键,
故选C.
点评 本题考查原子结构和元素性质及化学键,侧重考查基本概念、基本理论,熟悉元素周期表结构、物质结构即可解答,注意H元素易漏掉而导致错误.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
12.研究小组以Ag-ASM-5为催化剂,测得NO转化为N2的转化率随温度变化情况如图,由图得出的正确结论是( )
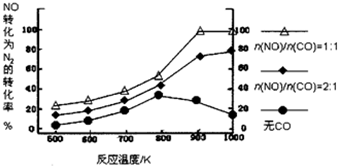

| A. | CO对NO转化为N2起抑制作用 | |
| B. | CO的催化效果随温度升高而提高 | |
| C. | NO的分解反应为放热反应 | |
| D. | $\frac{n(NO)}{n(CO)}$=1时,应控制的最佳温度在1000K |
2.已知某炔烃与卤素按物质的量为1:2发生加成反应,反应后,生成的有机物至少需6mol的卤素单质才能把生成的有机物中的氢全部取代,则该炔烃可能是( )
| A. | 丙炔 | B. | 1-丁炔 | C. | 3-己炔 | D. | 2-庚炔 |
19.用一种试剂就能鉴别乙醇、乙酸、乙醛、甲酸四种物质.该试剂可以是下列中的( )
| A. | 银氨溶液 | B. | 溴水 | ||
| C. | 高锰酸钾溶液 | D. | 新制氢氧化铜悬浊液 |
6.下列说法正确的是( )
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 可以在元素周期表中金属与非金属元素分界线附近寻找合适的半导体材料 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
16.下列叙述中正确的是( )
| A. | 周期表中第VA族元素的最高价氧化物对应水化物的化学式均为H3RO4 | |
| B. | O22-与S2-具有相同的质子数和电子数 | |
| C. | 所有主族元素的简单离子所带电荷数与其族序数相等 | |
| D. | 氕化锂、氘化锂、氚化锂可以作为“长征2号”火箭发射的重要燃料,LiH、LiD、LiT的化学性质不同 |
3.下列叙述正确的是( )
| A. | 非极性键不可能存在于离子化合物中 | |
| B. | 制催化剂的材料和制耐高温、耐腐蚀的合金材料可在过渡元素中寻找 | |
| C. | 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热 | |
| D. | 单质分子中均不存在化学键 |