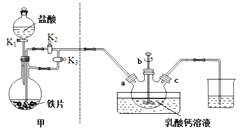
题目内容
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
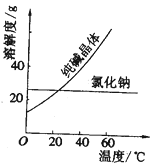
材料一、(见图)
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
【答案】HNO3 CO32 Ba(NO3)2 SO42 AgNO3 Cl C A
【解析】
(1)检验SO42-,需使用Ba2+;检验CO32-,需使用H+;检验Cl-,需使用Ag+。
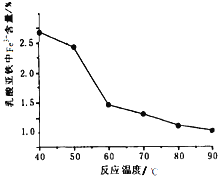
(3)从曲线图中可以看出,氯化钠和纯碱都是易溶于水的盐,二者的溶解度受温度的影响不同,可通过改变温度,将纯碱分离出来。
(4)乙二醇和丙三醇是沸点相差较大的两种有机物,可利用沸点的差异,将二者分离开来。
(1)由前面的分析可知,将SO42-、CO32-、Cl-分离开来,必须先检验CO32-,再检验SO42-,最后检验Cl-。
①先加入HNO3,检验CO32,故答案为:HNO3;CO32;
②然后加入Ba(NO3)2,检验SO42,故答案为:Ba(NO3)2;SO42;
③最后加入AgNO3,检验Cl,故答案为: AgNO3;Cl;
(2) ①从溶解度曲线看,氯化钠和纯碱的溶解度受温度影响不同,最好应用结晶法提取纯碱,故答案为:C;
②从表中数据看,乙二醇和丙三醇的沸点相差较大,可利用蒸馏法分离,故答案为:A。

 应用题作业本系列答案
应用题作业本系列答案