题目内容
【题目】同温同压下,若A容器中充满气体O2和B容器中充满气体O3
(1)若所含分子总数相等,则A容器和B容器的容积之比是____。
(2)若两容器中所含原子总数相等,则A容器和B容器的容积比是___。
(3)若A容器和B容器的体积比为3∶2,则气体O2和气体O3质量之比为___,密度之比为____。
【答案】1:1 3:2 1:1 2:3
【解析】
A容器中氧气的摩尔质量为32g/mol,B容器中臭氧的摩尔质量为48g/mol,利用阿伏伽德罗定律及其推论进行分析;
(1)同温同压同分子数,依据阿伏伽德罗定律可知同体积;
(2)根据原子数相等可知物质的量之间的关系,利用体积之比等于物质的量之比进行计算;
(3)同温同压下,体积之比等于物质的量之比,再利用![]() 计算质量之比,结合密度公式可知密度之比。
计算质量之比,结合密度公式可知密度之比。
(1)同温同压同分子数,依据阿伏伽德罗定律可知同体积,即体积之比为分子数之比,是1:1;
(2)由于两容器中所含原子总数相等,可知分子数之比即物质的量之比是3:2,而同温同压下体积之比等于物质的量之比,可得体积比为3:2;
(3)同温同压下,体积之比等于物质的量之比,A容器和B容器的体积比为3∶2,即![]() ,又
,又![]() ,得
,得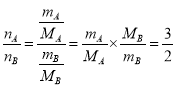 ,MA=32g/mol ,MB=48g/mol,那么有
,MA=32g/mol ,MB=48g/mol,那么有![]() ,即质量比为1:1;同温同压下,密度之比等于摩尔质量之比,则
,即质量比为1:1;同温同压下,密度之比等于摩尔质量之比,则![]() ,即密度之比为2:3。
,即密度之比为2:3。

【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
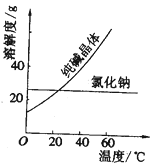
材料一、(见图)
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。
【题目】有X、Y、Z、W四种短周期主族元素,原子序数依次增大,元素性质与原子(或分子)结构如下表所示:
元素编号 | 元素性质与原子(或分子)结构 |
X | 原子核内没有中子 |
Y | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Z | 最内层电子数是最外层的2倍 |
W | 本周期元素中原子半径最小 |
请回答:
(1)写出元素Z在周期表中的位置______,画出元素W的原子结构示意图______。
(2)Y与W相比,气态氢化物稳定性较弱的是________(填化学式,下同),两元素最高价氧化物对应水化物酸性更强的是__________。
(3)X、Y、Z三种元素可以形成化合物ZYX2,可与化合物XW发生反应,生成两种盐,写出该反应的化学方程式________________。