题目内容
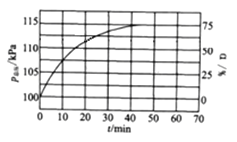
【题目】有一稀硫酸和硝酸铁的混合溶液,向其中加入铁粉,溶液中的Fe2+浓度如图所示(不考虑溶液体积的变化):

(1)溶液中H2SO4与Fe(NO3)3的物质的量之比为_________
(2)请写出详细的计算过程_________。
【答案】2:1 加入铁粉,首先发生反应4H++ NO3-+ Fe = Fe3+ + NO↑ + 2H2O,NO3-消耗完后,继续发生反应2Fe3+ + Fe =3Fe2+,
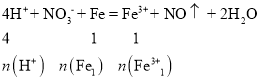 ,
,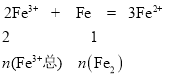 ,
,![]() ,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)= 4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。
,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)= 4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。
【解析】
加入铁粉,首先发生反应4H++ NO3-+ Fe = Fe3+ + NO↑ + 2H2O,NO3-消耗完后,继续发生反应2Fe3+ + Fe =3Fe2+,据此列比例计算。
加入铁粉,首先发生反应4H++ NO3-+ Fe = Fe3+ + NO↑ + 2H2O,NO3-消耗完后,继续发生反应2Fe3+ + Fe =3Fe2+,
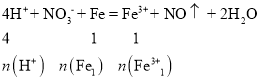 ,
,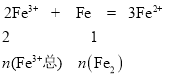
![]() ,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)=4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。
,同理,n(Fe2)=0.35mol,则n(Fe3+总)=0.7mol,n(H+)=4n(Fe1)=1.4mol,所以n(H2SO4)=0.7mol,原溶液中Fe3+物质的量n(Fe3+原)= n(Fe3+总)-n(Fe3+1)=0.7-0.35=0.35mol,所以硫酸和硝酸铁的物质的量之比为2:1。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案【题目】海带含有大量的碘,每1000g海带中含碘5g左右。实验室中,从海藻里提取碘的部分流程如下图。
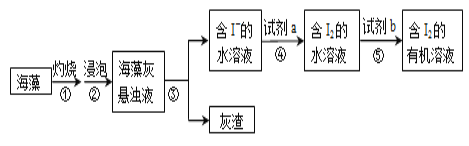
(1)③的操作名称是_______,所需的玻璃仪器有:_______⑤的操作名称是_______。
(2)试剂b可以是四氯化碳,还可以是_______(填名称)。选择四氯化碳的理由是:_____
(3)关于⑤的操作步骤,下列说法正确的是__________(填字母)。
A 振荡液体时,需要倒转分液漏斗
B 充分振荡液体后,将分液漏斗放置在铁架台上,立即分液
C 分液时,上下层液体都要从分液漏斗下口沿着烧杯内壁流入不同的烧杯
D 分液时,需要塞紧分液漏斗上方的玻璃塞,使分液漏斗密封
(4)试剂a可选用稀硫酸酸化的过氧化氢溶液,补全步骤④反应的离子方程式:
_____I― +______H2O2+_________=_______I2+_________。(系数为“1”时,要写“1”)
(5)某兴趣小组设计实验方案,从含I2的CCl4溶液中分离I2和CCl4。已知:
物质 | 熔点 | 沸点 |
I2 | 114℃ | 184℃ |
CCl4 | -23℃ | 77℃ |
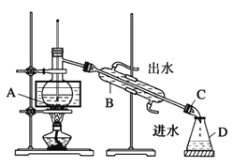
①小组同学根据资料,采用了蒸馏的方法,组装了如下图装置,仪器B的名称是_____,②图中有一个明显错误,应改正为_____________。
【题目】(1)某溶液中含有SO42-、CO32-、Cl-,若只允许取一次该溶液而把三种离子分别检验出来,则应采取的措施是:
①先加入_____________检验_____________________;
②然后加入_________________,检验_____________;
③最后加入______________检验____________________________。
(2)阅读、分析下列两个材料:
材料一、(见图)
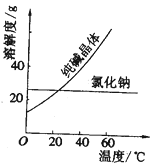
材料二、
物质 | 熔点/℃ | 沸点/℃ | 密度/g·cm3 | 溶解性 |
乙二醇( C2H6O2) | 11.5 | 198 | 1.11 | 易溶于水和乙醇 |
丙三醇(C3H8O3) | 17.9 | 290 | 1.26 | 能跟水、酒精以任意比互溶 |
回答下列问题(填写序号):
A.蒸馏法 B.萃取法
C.“溶解、结晶、过滤”的方法 D.分液法
①纯碱从氯化钠和纯碱的混合物中分离出来,最好应用______。
②将乙二醇和丙三醇相互分离的最佳方法是__________。