题目内容
将4mol SO2(g)与2molO2(g)放入4L的密闭容器中,在一定条件下反应达到平衡:
2SO2(g)+ O2(g) 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
2SO2(g)+ O2(g)
 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:(1)平衡时各物质的浓度;
(2)平衡时SO2的转化率。
(10分)
解:设平衡时SO2转化的物质的量为2a
 2SO2(g) + O2(g) 2SO3(g)
2SO2(g) + O2(g) 2SO3(g)
起始 4 mol 2 mol 0
转化 2a a 2a
平衡 4-2a 2-a 2a
4-2a+2-a+2a=5
a=1 (6分)
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol n(O2)="1" mol n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L c(O2)=0.25mol/L c(SO3)="0.5" mol/L (2分)
平衡时SO2的转化率="2" mol /4 mol×100%=50% (2分)
解:设平衡时SO2转化的物质的量为2a
 2SO2(g) + O2(g) 2SO3(g)
2SO2(g) + O2(g) 2SO3(g)起始 4 mol 2 mol 0
转化 2a a 2a
平衡 4-2a 2-a 2a
4-2a+2-a+2a=5
a=1 (6分)
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol n(O2)="1" mol n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L c(O2)=0.25mol/L c(SO3)="0.5" mol/L (2分)
平衡时SO2的转化率="2" mol /4 mol×100%=50% (2分)
试题分析:解:设平衡时SO2转化的物质的量为2a
2SO2(g) + O2(g)
 2SO3(g)
2SO3(g)起始 4 mol 2 mol 0
转化 2a a 2a
平衡 4-2a 2-a 2a
4-2a+2-a+2a=5
a=1
∴平衡时各物质的物质的量分别为
n(SO2)="2" mol n(O2)="1" mol n(SO3)="2" mol
∴平衡时各物质的物质的量浓度分别为
c(SO2)="0.5" mol/L c(O2)=0.25mol/L c(SO3)="0.5" mol/L
平衡时SO2的转化率="2" mol /4 mol×100%=50%
点评:本题考查了三行式的应用;对于化学平衡的计算常用此法,学生要多加练习,此类问题便不难解决。

练习册系列答案
相关题目
 5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。
5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。 C(g)+D(g)已达平衡的是
C(g)+D(g)已达平衡的是  2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是 
 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 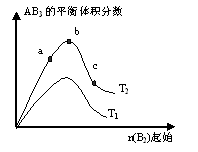
 2HI(g) ②C(s)+H2O(g)
2HI(g) ②C(s)+H2O(g) 3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( )
3C(g)达到平衡时,测得c(A)=0.5 mol/L。在温度不变的情况下,将容积增大一倍,当达到新的平衡时,测得c(A)=0.25 mol/L。下列判断中正确的是( ) 2 NH3的说法不正确的是( )
2 NH3的说法不正确的是( ) cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( )
cC(g)+dD(g),达到平衡后将气体体积压缩到原来的一半,当再次达到新平衡时,D的浓度为原来的1.8倍,下列说法正确的是 ( )