题目内容
(3分)牙齿的损坏实际是牙釉质[Ca5(PO4)3OH]溶解的结果,在口腔中存在如下平衡:Ca5(PO4)3OH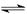 5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。
5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。
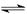 5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。
5Ca2+ +3PO43― +OH―当糖附在牙齿上发酵时会产生H+,试运用化学平衡理论说明经常吃糖对牙齿的影响。①糖附在牙齿上发酵时会产生H+ 1'
②H+与牙釉质溶解得到的OH― 结合成水 1'
③使该平衡右移,牙釉质溶解,经常吃糖会损坏牙齿 1'
试题分析:本题给出已知条件,引导学生朝着化学反应平衡移动的角度去分析,当糖附在牙齿上发酵时会产生H+,然后与OH―结合,使平衡向着正反应方向移动,牙釉质[Ca5(PO4)3OH]溶解,因此经常吃糖会损坏牙齿。
点评:本题结合生活实际,事实上考查了化学反应平衡的移动,利用勒夏特列原理进行解析。

练习册系列答案
相关题目
 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求: 2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据: HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
HCO3-+OH-平衡,若通入CO2,则平衡逆向移动 H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是
H2(g) + Br2(g) (正反应为吸热反应) 达到化学平衡时,要使混合气体的颜色加深,可采取的方法是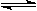 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示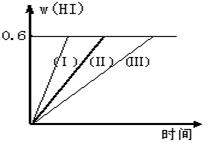
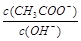 变大
变大 (g)+1/2O
(g)+1/2O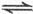 SO
SO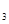 (g)△H=-98.32kJ/mol,现有4molSO
(g)△H=-98.32kJ/mol,现有4molSO