题目内容
一定条件下,可逆反应X(g)+3Y(g) 2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是

 2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是
2Z(g);若X、Y、Z起始浓度分别为C1、C2、C3(均不为0),平衡时X、Y、Z的浓度分别为0.1mol/L、0.3 mol/L、0.08 mol/L,则下列判断不合理的是 
| A.C1:C2=1:3 | B.平衡时,Y和Z的生成速率之比为3 :2 |
| C.反应过程中X、Y的转化率不相等 | D.C1取值范围为0<C1<0.14 mol/L |
C
试题分析:若反应向正反应进行到达平衡,X2、Y2的浓度最大,Z的浓度最小,假定完全反应,则:
根据方程式 X2(气)+3Y2(气)
 2Z(气)
2Z(气)开始(mol/L): c1 c2 c3
变化(mol/L): 0.04 0.12 0.08
平衡(mol/L): 0.1 0.3 0.08
c1=0,14 c2=0.42 c3=0
若反应逆正反应进行到达平衡,X2、Y2的浓度最小,Z的浓度最大,假定完全反应,则:
根据方程式 X2(气)+3Y2(气)
 2Z(气)
2Z(气)开始(mol/L): c1 c2 c3
变化(mol/L): 0.1 0.3 0.2
平衡(mol/L): 0.1 0.3 0.08
c1=0 c2=0 c3=0.28
由于为可能反应,物质不能完全转化所以平衡时浓度范围为0<c(X2)<0.14,0<c(Y2)<0.42,0<c(Z)<0.28。A.X2 和Y2平衡浓度为1:3,变化的量为1;3,所以起始量为1:3,c1:c2=1:3,故A正确;B.平衡时,Y和Z的生成速率之比为化学方程式系数之比为3:2,故B正确;C.XY的变化量之比和起始量之比相同,所以转化率相同,故C错误;D.依据上述计算,C1的取值范围为0<C1<0.14mol?L-1,故D正确,答案选D。
点评:该题是中等难度的试题,试题综合性强,注重能力的培养和解题方法的训练。该题学生需要明确的是化学平衡的建立,既可以从正反应开始,也可以从逆反应开始,或者从正逆反应开始,不论从哪个方向开始,物质都不能完全反应,利用极限法假设完全反应,计算出相应物质的浓度变化量,实际变化量小于极限值,据此判断分析即可,有助于培养学生的逻辑推理能力和抽象思维能力。

练习册系列答案
相关题目
 3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后,A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是
3C(g),若反应开始时充入2 mol A和2 mol B,达平衡后,A的体积分数为a%。其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是 2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ( )
2C(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是 ( ) 2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( ) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )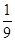


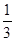
 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求: