题目内容
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)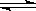 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 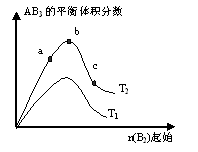
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之比接近3∶1
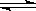 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据右图可得出的判断结论正确的是 
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为:b>a>c
C.若T2>T1,则正反应一定是吸热反应
D.b点时,平衡体系中A、B原子数之比接近3∶1
C
试题分析:A、由于不知道T2与T1的大小关系,所以不能判断反应时吸热还是放热,故错B、曲线先增加,原因是加入气体B2时,平衡正向移动。然后曲线再降低,原因是通入的气体量大,总气体体积增大显著。使得AB3的体积分数减小,实际上平衡仍旧在向正向移动,所以转化率比较应该是c>b>a。故错。
C、若T2>T1,温度越高,平衡时含量AB3越多,平衡正移,则正反应是吸热反应,故正确。
D、b点时,平衡体系中A、B原子数之比接近1∶3故错
点评:本题难度适中,利用勒夏特列原理来解题,注意温度对化学平衡的影响。本题需要把图像看懂,首先看横纵坐标,再看曲线的变化,再分析变化的原因。

练习册系列答案
相关题目
 2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是
2C(g);△H<0,①容器容积固定,外有隔热套 ②容器容积固定 ③容器有活塞可移动。下列说法正确的是 2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( )
2SO3(g),已知c(SO2)始=0.4 mol·L-1,c(O2)始=1 mol·L-1,经测定该反应在该温度下的平衡常数K=19,则此反应中SO2的转化量为 ( ) CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )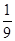
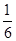
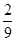
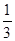
 Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将( )
Fe(SCN)3+3KCl,向该平衡体系中加入少量KCl固体,红色将( ) 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
 N2O4平衡体系 ,向生成N2O4的方向移动
N2O4平衡体系 ,向生成N2O4的方向移动 2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2 (g) △H>0,隔一段时间对该容器内的物质进行分析,得到如下数据: