题目内容
有关工业合成氨的反应:N2+ 3H2 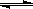 2 NH3的说法不正确的是( )
2 NH3的说法不正确的是( )
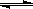 2 NH3的说法不正确的是( )
2 NH3的说法不正确的是( )| A.该反应为可逆反应,故在一定条件下N2和H2不可能全部转化为NH3 |
| B.达到平衡后,反应就停止了,故正、逆反应速率相等且均为零 |
| C.一定条件下,向某密闭容器中加入1mol N2和3mol H2,则从反应开始到平衡的过程中,正反应速率不断减小,逆反应速率不断增大,某一时刻,正、逆反应速率相等 |
| D.在利用上述反应生产NH3时,要同时考虑反应所能达到的限度和化学反应速率两方面的问题 |
B
试题分析:在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态,所以选项B是错误的,其余选项都是正确的,答案选B。
点评:该题是基础性试题的考查,也是反应速率、平衡状态在实际工业生产中的综合应用。有利于培养学生的逻辑推理能力和发散思维能力。

练习册系列答案
相关题目
 CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )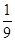


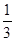
 2SO3(g) 测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) 测得平衡时混合物总的物质的量为5mol,求: 2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
2SO3经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
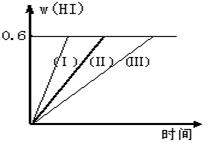
 N2O4平衡体系 ,向生成N2O4的方向移动
N2O4平衡体系 ,向生成N2O4的方向移动 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示