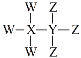题目内容
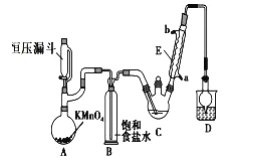
【题目】三氯乙醛(CCl3CHO)是生产农药、医药的重要中间体,实验室制备三氯乙醛的反应装置示意图(加热装置未画出)和有关数据如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
②相关物质的相对分子质量及部分物理性质:
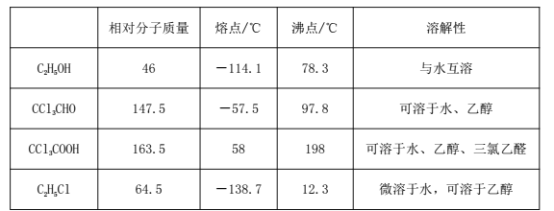
(1)恒压漏斗中盛放的试剂的名称是_____,盛放KMnO4仪器的名称是_____。
(2)反应过程中C2H5OH和HCl可能会生成副产物C2H5Cl,同时CCl3CHO(三氯乙醛)也能被次氯酸继续氧化生成CCl3COOH(三氯乙酸),写出三氯乙醛被次氯酸氧化生成三氯乙酸的化学方程式______。
(3)该设计流程中存在一处缺陷是______,导致引起的后果是______,装置B的作用是____。
(4)反应结束后,有人提出先将C中的混合物冷却到室温,再用分液的方法分离出三氯乙酸。你认为此方案是否可行____(填是或否),原因是______。
(5)测定产品纯度:称取产品0.36g配成待测溶液,加入0.1000molL 1碘标准溶液 20.00mL,再加适量Na2CO3溶液,反应完全后加盐酸调溶液pH,立即用0.02000molL 1Na2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液20.00mL。则产品的纯度为_____(计算结果保留四位有效数字)。滴定原理:CCl3CHO+OH-=CHCl3+HCOO-、HCOO-+I2=H++2I-+CO2、I2+2S2O32-=2I-+S4O62-
【答案】浓盐酸 圆底烧瓶 CCl3CHO+HClO→CCl3COOH+HCl 无干燥装置 副产物增多 除去氯气中的氯化氢 否 三氯乙酸会溶于乙醇和三氯乙醛,无法分液 73.75%
【解析】
装置A是氯气的发生装置,根据反应原理应为高锰酸钾和浓盐酸反应;遵循化学方程式书写原则;实验室制氯气反应有杂质,所以发生装置后要接除杂装置和干燥装置,装置B可以去除氯气中的氯化氢,但是缺少一个干燥装置来除去水分,若不除去水分,氯气和水反应得到次氯酸和盐酸,会生成更多的副产物;三氯乙酸是有机物,会溶于乙醇和三氯乙醛,根据题目给出的沸点可知此处用蒸馏的方法最适合;根据给出方程式,按照关系式进行计算即可。据此分析。
(1)根据反应原理我们发现原料需要氯气,因此装置A就应该是氯气的发生装置,所以恒压漏斗里装的是浓盐酸;盛放KMnO4的装置是圆底烧瓶;答案为:浓盐酸;圆底烧瓶;
(2)按照要求来书写方程式即可,应注意次氯酸的还原产物是氯化氢而不是氯气;方程式为:CCl3CHO+HClO→CCl3COOH+HCl;答案为:CCl3CHO+HClO→CCl3COOH+HCl;
(3)制得的氯气中带有氯化氢和水分,氯化氢可以在装置B中除去,但是缺少一个干燥装置来除去水分,若不除去水分,氯气和水反应得到次氯酸和盐酸,会生成更多的副产物;答案为:无干燥装置;副产物增多;除去氯气中的氯化氢;
(4)该方案不行,因为三氯乙酸是有机物,会溶于乙醇和三氯乙醛,根据题目给出的沸点可知此处用蒸馏的方法最适合;答案为:否;三氯乙酸会溶于乙醇和三氯乙醛,无法分液;
(5)根据n=c×V=0.02 molL1×0.02L=4×10-4mol即为消耗的Na2S2O3的物质的量,根据2:1的系数比,此Na2S2O3对应消耗过量的2×10-4mol单质碘,起始加入的碘的物质的量为n=c×V=0.1 molL1×0.02L =2×10-3mol;因此整个过程中消耗了1.8×10-3mol单质碘,再次根据化学计量数之比CCl3CHO:I2为1:1可得产品中有1.8×10-3mol三氯乙醛,质量为m=n×M=1.8×10-3mol×147.5g∕mol=0.2655g,产品的纯度为![]() ;答案为73.75%;
;答案为73.75%;

【题目】在25 ℃时,向AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液,观察到的现象是先出现黄色沉淀,最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如表所示:
AgCl | AgI | Ag2S | |
Ksp | 1.8×1010 | 8.3×1017 | 6.3×1050 |
下列叙述错误的是
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同