题目内容
【题目】研究碳氧化物、氮氧化物、硫氧化物等大气污染物的处理,对缓解环境污染、能源危机具有重要意义。
(1)已知CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1
CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1
则2NO(g)+2CO(g)![]() N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
N2(g)+2CO2(g),ΔH=___ kJ·mol-1。
(2)氮氧化物和硫氧化物在一定条件下会发生反应,NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
SO3(g)+NO(g) ΔH<0,从而实现物质转换降低能耗。某化学小组对该反应进行相关实验探究:在固定体积的密闭容器中,使用某种催化剂,改变原料气配比进行多组实验(各次实验的温度可能相同,也可能不同),测得NO2的平衡转化率如图所示:
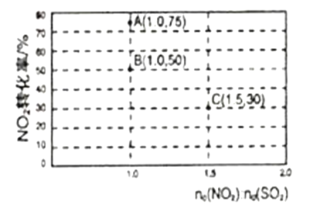
①如果要将图中B点改变为A点,应采取的措施是___;
②若B点对应实验中,SO2(g)的起始浓度为c0mol·L-1,经过tmin达到平衡状态,该时段反应速率υ(NO2)=____mol·L-1·min-1,化学平衡常数K=___;
③图中B、C两点对应的实验温度分别为TB和TC,通过计算判断TB__TC(填>、=、或<)。
(3)SCR(选择性催化还原)脱硝法是工业上消除氮氧化物的常用方法。主要反应原理为:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
4N2(g)+6H2O(g) ΔH<0。其他条件相同在甲、乙两种催化剂作用下,经过相同时间,NO转化率与温度的关系如图所示。
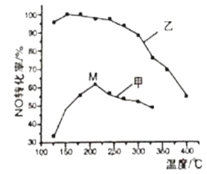
①工业上选择催化剂____(填“甲”或“乙”)原因是____。
②在催化剂甲的作用下,图中M点处(对应温度为210℃)NO的转化率___(填“可能是”、“一定是”或“一定不是”)该温度下的平衡转化率。高于210℃时NO的转化率降低的原因可能是___。
【答案】-744.9 降低温度 ![]() 1 < 乙 乙的催化活性高(或乙的催化效率高) 一定不是 催化剂活性降低(或副反应增多)
1 < 乙 乙的催化活性高(或乙的催化效率高) 一定不是 催化剂活性降低(或副反应增多)
【解析】
(1)根据盖斯定律计算ΔH;
(2)①如果要将图中B点的平衡状态改变为A点的平衡状态,平衡转化率增大,平衡正向进行;
②根据反应速率![]() 、
、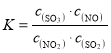 计算即可;
计算即可;
③图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,C点二氧化氮转化率30%,计算B、C点对应反应的平衡常数判断反应温度高低;
(3)①根据图象,催化剂在低温下对NO转化率的影响分析;
②使用不同催化剂、温度相同时平衡转化率应相等;甲催化剂随温度升高NO转化率先增大后减小,高于210℃时,NO转化率降低是催化剂活性降低;
(1)①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1;
CO2(g)+H2(g) ΔH1=-41.2kJ·mol-1;
②CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1;
2CO(g)+2H2(g) ΔH2=+247.3kJ·mol-1;
③CH4(g)+4NO(g)![]() 2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1;
2N2(g)+CO2(g)+2H2O(g) ΔH3=-1160.0kJ·mol-1;
根据盖斯定律,将![]() ×(③-②+①×2)得:2NO(g)+2CO(g)
×(③-②+①×2)得:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH=-744.9 kJ·mol-1;故答案为:-744.9;
N2(g)+2CO2(g) ΔH=-744.9 kJ·mol-1;故答案为:-744.9;
(2)①如果要将图中B点的平衡状态改变为A点的平衡状态,平衡转化率增大,平衡正向进行,正反应为放热反应,降低温度,平衡正向移动,转化率增大,故答案为:降低温度;
②B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0molL-1,c(NO2)=c0 molL-1,根据三段式:
NO2 (g) + SO2 (g) SO3 (g) + NO (g)
起始量(mol/L) c0 c0 00
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
![]() ;
;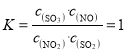 ,故答案为:
,故答案为:![]() ;;
;;
③NO2(g)+SO2(g)![]() SO3(g)+NO(g) ΔH<0,反应为放热反应,图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0molL-1,c(NO2)=c0 molL-1,根据三段式:
SO3(g)+NO(g) ΔH<0,反应为放热反应,图中B、C两点对应的实验温度分别为TB和TC,B点二氧化氮转化率为50%,n(NO2):n(SO2)=1, SO2(g)的起始浓度为c0molL-1,c(NO2)=c0 molL-1,根据三段式:
NO2 (g) + SO2 (g) SO3 (g) + NO (g)
起始量(mol/L) c0 c0 00
变化量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
平衡量(mol/L) 0.5c0 0.5c0 0.5c0 0.5c0
B点平衡常数K(B)=1,
C点二氧化氮转化率30%,n(NO2):n(SO2)=1.5,SO2(g)的起始浓度为c0molL-1,c(NO2)=1.5c0mol/L,根据三段式:
NO2 (g) + SO2 (g) SO3 (g) + NO (g)
起始量(mol/L)1.5c0 c0 00
变化量(mol/L)0.45c0 0.45c0 0.45c0 0.45c0
平衡量(mol/L)1.05c0 0.55c0 0.45c0 0.45c0
平衡常数K(C)=0.35;
平衡常数:B点大于C点,说明反应温度TB<TC,故答案为:<;
(3)①结合图象中曲线变化可知,低温下使用催化剂乙在相同时间内NO的转化率大,使用催化剂乙反应速率快,工业上选择催化剂乙,
故答案为:乙;乙的催化活性高(或乙的催化效率高);
②M点NO的转化率小于相同温度下使用催化剂乙时NO的转化率,则图中M点(对应温度为210℃)NO的转化率一定不是该温度下的平衡转化率;使用甲催化剂随温度升高NO转化率先增大后减小,高于210℃时,NO转化率降低是催化剂活性降低或副反应增多,故答案为:一定不是;催化剂活性降低(副反应增多);