题目内容
【题目】某些过渡元素的相关化合物在化工、医药、材料等领域有着极为广泛的应用。回答下列问题:
(1)现有铜锌元素的4种微粒,①锌:[Ar]3d104s2;②锌:[Ar]3d104s1;③铜:[Ar]3d104s1;④铜:[Ar]3d10。失去一个电子需要的最低能量由大到小的顺序是___(填字母)。
A ④②①③ B ④②③① C ①②④③ D ①④③②
(2)砷化镉(Cd3As2)是一种验证三维量子霍尔效应的材料。
①砷与卤素可形成多种卤化物,AsBr3、AsCl3、AsF3的熔点由低到高的顺序为__。砷酸的酸性弱于硒酸,从分子结构的角度解释原因____。
②Cd2+与NH3形成配离子[Cd(NH3)4]2+中,配体的空间构型为__,画出配离子的结构式__(不考虑立体构型)。
(3)铬(Cr)、钼(Mo)、钨(W)位于同一副族相邻周期,且原子序数依次增大。
①基态铬原子、钼原子的核外电子排布特点相同,则基态钼原子的价层电子排布图为___。
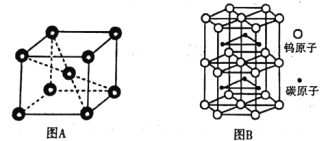
②铬的晶胞结构如图A所示,它的堆积模型为____,在该晶胞中铬原子的配位数为_____。
③钨和碳能形成耐高温、耐磨材料碳化钨,其晶胞结构如图B所示,则碳化钨的化学式为___,六棱柱的底边长为a cm,高为b cm,设阿伏加德罗常数的值为NA,则碳化钨晶体的密度是___g·cm-3(列出计算表达式)。
【答案】A AsF3<AsCl3<AsBr3 H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中O原子上的电子向Se偏移的程度大,更容易电离出H+ 三角锥形 
![]() 体心立方堆积 8 WC
体心立方堆积 8 WC 
【解析】
(1)结合电离能的变化规律分析解题,注意d轨道全充满的稳定结构,电离能较大;
(2)①AsCl3、AsF3、AsBr3都是分子晶体,根据分子间作用力大小及影响因素与熔点关系分析;非羟基氧越多,酸性越强;
②[Cd(NH3)4]2+中配体是NH3,根据N原子的价电子对数目分析空间构型;Cd2+与NH3通过配位键结合成配合离子;
(3)铬原子核电荷数为24,晶胞的特点是一个Cr原子位于八个Cr原子形成的立方体中心;利用均摊法确定碳化钨的化学式,计算出晶胞的质量和体积,再根据![]() 计算密度。
计算密度。
(1)锌原子的第一电离能大于铜原子第一电离能,有①>③;铜的第二电离能大于锌的第二电离能,有④>②,锌的第二电离能大于第一电离能,②>①,即失去一个电子需要的最低能量由大到小的顺序是④②①③,故答案为A;
(2)①AsBr3、AsCl3、AsF3都是分子晶体,相对分子质量越大,范德华力越大,熔点越高,故熔点由低到高的顺序为AsF3<AsCl3<AsBr3;H2SeO4的非羟基氧原子多,Se的正电性更高,羟基中的O原子的电子向Se偏移程度大,更容易电离出H+,砷酸的酸性弱于硒酸;
②NH3中N原子的价层电子对数目为3+![]() =4,其中有1个孤对电子,N原子为sp3杂化,空间构型是三角锥形;Cd2+与NH3通过配位键结合成配合离子,N原子提供孤对电子,中心离子与4个NH3形成4个配位键,则配离子的结构式为
=4,其中有1个孤对电子,N原子为sp3杂化,空间构型是三角锥形;Cd2+与NH3通过配位键结合成配合离子,N原子提供孤对电子,中心离子与4个NH3形成4个配位键,则配离子的结构式为 ;
;
(3)①基态铬原子的价电子排布式为3d54s1,钼原子与铬原子的核外电子排布特点相同,则基态钼原子的价电子排布式为4d55s1,故价层电子排布图为![]() ;
;
②由铬的晶胞结构可知,一个Cr原子位于八个Cr原子形成的立方体中心,则堆积模型为体心立方堆积,在该晶胞中铬原子的配位数为8;
③晶胞中碳原子数为6个,钨原子数为1+2×![]() +6×2×
+6×2×![]() +6×
+6×![]() =6,则碳化钨的化学式为WC;晶胞的质量为
=6,则碳化钨的化学式为WC;晶胞的质量为![]() g,晶胞的体积为
g,晶胞的体积为![]() cm3,则晶胞密度
cm3,则晶胞密度![]() =
= 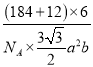 g·cm-3。
g·cm-3。







