题目内容
10.下列应用涉及氧化还原反应的是( )| A. | 用食醋清洗烧水壶的水垢 | |
| B. | 用铝盐、铁盐作净水剂 | |
| C. | 用硫磺粉处理散落在地上的汞 | |
| D. | 用丁达尔现象区分食盐水和淀粉溶液 |
分析 发生的化学反应中,若存在元素的化合价变化,则发生氧化还原反应,以此来解答.
解答 解:A.醋酸与碳酸钙反应生成醋酸钙、水、二氧化碳,没有元素的化合价变化,不发生氧化还原反应,故A不选;
B.用铝盐、铁盐作净水剂,铝离子和铁离子发生水解反应,没有元素的化合价变化,不发生氧化还原反应,故B不选;
C.用硫磺粉处理散落在地上的汞,S、Hg元素的化合价发生变化,发生氧化还原反应,故C选;
D.丁达尔效应属于物理变化,用丁达尔现象区分食盐水和淀粉溶液,没有发生化学变化,不是氧化还原反应,故D不选;
故选C.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应判断的考查,题目难度不大.

练习册系列答案
相关题目
20.经测定某溶液中离子只有Na+、CH3COO-、H+、OH-四种,且离子浓度大小的排列顺序为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则不可能的情形是( )
| A. | 由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成 | |
| B. | 由0.2 mol/L CH3COOH溶液与0.1 mol/L NaOH溶液等体积混合而成 | |
| C. | 由0.1 mol/LCH3COOH溶液与等物质的量浓度等体积的NaOH溶液混合而成 | |
| D. | 向上述溶液中加入适量NaOH,可能使溶液中离子浓度大小改变为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
1.下列说法正确的是( )
| A. | 淀粉、纤维素和油脂都属于天然高分子化合物 | |
| B. | 蛋白质溶液中加入硫酸铜溶液,有白色沉淀产生,加水,白色沉淀重新溶解 | |
| C. | 等质量的CH4、C2H4、C2H2分别在氧气中完全燃烧,消耗氧气的量依次减少 | |
| D. | 分子式为C2H4O2与C4H8O2的两种物质一定属于同系物 |
18.下列各组离子在特定条件下能够大量共存的是( )
| A. | 无色溶液:SO42-、Cl-、Mg2+、NH4+ | |
| B. | 含有较多Ag+溶液:SO42-、K+、Na+、OH- | |
| C. | 能使石蕊试纸变红色的溶液:K+、SO32-、NO3-、Na+ | |
| D. | 含有较多的Al3+的溶液:Na+、SO42-、AlO2-、K+ |
15.国内科研机构对城市雾霾天气进行了研究,一种新的污染物过氧乙酰硝酸酯(PAN)被检出引起了人们的注意,研究表明对眼睛具有强烈刺激作用的过氧乙酰硝酸酯产生原理可用以下方程式表示为C2H6+NO2+O2→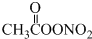 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )
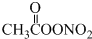 (未配平),下列有关说法正确的是( )
(未配平),下列有关说法正确的是( )| A. | C2H6分子中只存在极性键 | |
| B. | PAN中氧元素化合价均为-2 | |
| C. | 每消耗11.2L O2转移电子的物质的量为2 mol | |
| D. | PAN可水解成硝酸和有机酸,是导致酸雨的原因之一 |
2.下列各组微粒在指定溶液中一定能大量共存的是( )
| A. | 石蕊变红色的溶液:Na+、Mg2+、Cl-、SO42- | |
| B. | 能溶解氧化铝粉末的溶液中:K+、N03-、Cl-、NH4+ | |
| C. | 滴加苯酚溶液显紫色的溶液:NH4+、K+、Cl-、H2S | |
| D. | 由水电离出的c(H+)=10-12mol.L-1的溶液:Na+、K+、NO3-、C6H5O- |
19.下列有关化学用于正确的是( )
| A. | NaHSO4的电离:NaHSO4=Na++H++SO${\;}_{4}^{2-}$ | |
| B. | 葡萄糖的结构简式:C6H12O6 | |
| C. | S2-的结构示意图: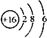 | |
| D. | 质子数为94,中子数为144的钚(Pu)原子:${\;}_{92}^{144}$Pu |
1.(1)某同学欲配制98.0mL0.10mol•L-1的CuSO4溶液.以下操作1~5是其配制的过程及示意图:

①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
| 操作1:准确称取一定质量的胆矾晶体并用适量蒸馏水溶解. 操作2:将所得溶液转移到仪器X中,用蒸馏水冲洗烧杯和玻璃棒2~3次,将洗涤液也转移到X中. 操作3:继续向X中加蒸馏水至液面 离X的刻度线l~2cm处. |

①仪器X的名称是100mL容量瓶.
②关于该配制过程,下列说法正确的是AB.
A.操作1中,应称取胆矾晶体的质量为2.5g
B.操作2中,洗涤液需要转移到仪器X中
C.操作4称为定容,由于该同学观察方法不正确,将导致所配溶液浓度偏高
D.操作5摇匀后静置,发现液面低于刻度线,应继续加水至凹液面与刻度线相切
(2)甲、乙同学用下图装置验证SO2和Cl2的漂白性:甲同学按1:1通气时,品红溶液几乎不褪色,品红溶液不褪色的原因是(用方程式表示):SO2+Cl2+2H2O=SO42-+2Cl-+4H+;而乙同学的实验现象是品红溶液随时间的推移变得越来越浅,乙同学做到让品红溶液变得越来越浅的原因是增加二氧化硫的通入量或增加氯气通入量.
 .
.