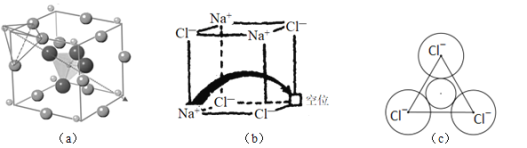
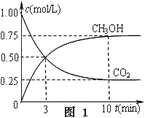
题目内容
【题目】铋及其化合物在工业生产中用途广泛,某研究小组用浮选过的辉铋矿(主要成分是Bi2S3,还含少量Bi2O3、SiO2等杂质)制备铋酸钠,其流程如下:
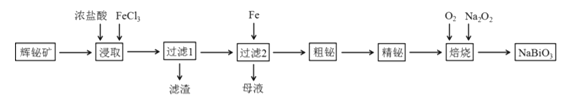
已知:①铋酸钠是一种难溶于水的物质;②水解能力:Bi3+>Fe3+。
回答下列问题:(1)“浸取”时,为了提高浸取速率,可采取的措施有______(任写一条);过滤1的滤渣中的某种主要成分可溶于一种弱酸,写出该反应的化学方程式______。
(2)浸取时加入过量浓盐酸的目的是______;“母液”中通入气体X后可循环利用,气体X为______(填名称)。
(3)写出焙烧时生成铋酸钠的化学方程式______。
(4)用![]() 双硫腙,二元弱酸
双硫腙,二元弱酸![]() 络合萃取法可从工业废水中提取金属离子:
络合萃取法可从工业废水中提取金属离子:![]() 先将金属离子络合成电中性的物质
先将金属离子络合成电中性的物质![]() 如
如![]() 等
等![]() ,再用
,再用![]() 萃取此络合物。图2是用上述方法处理含有
萃取此络合物。图2是用上述方法处理含有![]() 、
、![]() 、
、![]() 的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率)。
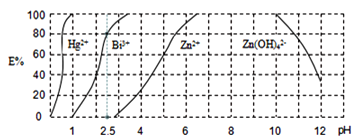
①当![]() :
:![]() :4时,废水的
:4时,废水的![]() ______。
______。
②向萃取后的![]() 中加入足量的NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___。
中加入足量的NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为___。
(5)取焙烧得到的![]() 样品
样品![]() ,加入稀硫酸和
,加入稀硫酸和![]() 溶液使其完全溶解。已知
溶液使其完全溶解。已知![]() 被还原为
被还原为![]() ,
,![]() 被氧化成成
被氧化成成![]() ,试写出该反应的离子方程式:____。然后用新配制的
,试写出该反应的离子方程式:____。然后用新配制的![]() 溶液对生成的
溶液对生成的![]() 进行滴定,滴定完成后稍耗
进行滴定,滴定完成后稍耗![]() 溶液。则该样品中
溶液。则该样品中![]() 纯度为____。
纯度为____。
【答案】粉碎矿石(或适当提高浸取时温度;适当提高FeCl3溶液浓度;浸取时不断搅拌等) ![]() 溶解
溶解![]() ,同时防止
,同时防止![]() 和
和![]() 水解生成不溶性沉淀,提高原料的浸出率 氯气
水解生成不溶性沉淀,提高原料的浸出率 氯气 ![]()
![]()
![]() 2.5
2.5 ![]()
![]() 44%
44%
【解析】
辉铋矿(主要成分是Bi2S3.还含少量Bi2O3,SiO2等杂质)制备铋酸钠,辉铋矿加入氯化铁溶液和盐酸溶解后过滤,氯化铁氧化硫离子为硫单质,盐酸是防止FeCl3及BiCl3水解生成不溶性沉淀,得到滤渣为SiO2和S,滤液中含有Bi3+,H+,Fe2+,滤液中加入铁粉过滤得到海绵铋,和滤液B主要是氯化亚铁,通入氯气后生成氯化铁,然后循环使用,海绵铋在氧气中加入过氧化钠发生氧化还原反应生成NaBiO3。
![]() 影响反应速率的因素有温度、浓度、固体接触面积等;二氧化硅能够溶于氢氟酸;
影响反应速率的因素有温度、浓度、固体接触面积等;二氧化硅能够溶于氢氟酸;
![]() 铁离子、铋离子易发生水解,加入浓盐酸可溶解
铁离子、铋离子易发生水解,加入浓盐酸可溶解![]() 、抑制铁离子、铋离子水解;母液”中含有亚铁离子,通入氯气可将亚铁离子氧化成铁离子,氯化铁可循环利用;
、抑制铁离子、铋离子水解;母液”中含有亚铁离子,通入氯气可将亚铁离子氧化成铁离子,氯化铁可循环利用;
![]() 铋与氧气、过氧化钠高温下反应生成
铋与氧气、过氧化钠高温下反应生成![]() ,据此书写化学方程式;
,据此书写化学方程式;
![]() 当水中
当水中![]() :
:![]() :4时,也就是属离子以络合物形式被萃取分离的百分率为
:4时,也就是属离子以络合物形式被萃取分离的百分率为![]() ,对就废水的
,对就废水的![]() ;
;
![]() 向萃取后的
向萃取后的![]() 中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为
中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为![]() ;
;
![]() 根据化合价升降相等配平发生反应,然后得出反应关系式,利用亚铁离子的物质的量计算出
根据化合价升降相等配平发生反应,然后得出反应关系式,利用亚铁离子的物质的量计算出![]() 物质的量,然后可计算出该样品中
物质的量,然后可计算出该样品中![]() 纯度。
纯度。
![]() 浸取”时,粉碎矿石、适当提高浸取时温度、适当提高
浸取”时,粉碎矿石、适当提高浸取时温度、适当提高![]() 溶液浓度、浸取时不断搅拌等都可以加快浸取速率;滤渣1中含有的
溶液浓度、浸取时不断搅拌等都可以加快浸取速率;滤渣1中含有的![]() 能够溶于弱酸HF,发生反应的化学方程式为:
能够溶于弱酸HF,发生反应的化学方程式为:![]() ,故答案为:粉碎矿石
,故答案为:粉碎矿石![]() 或适当提高浸取时温度;适当提高
或适当提高浸取时温度;适当提高![]() 溶液浓度;浸取时不断搅拌等
溶液浓度;浸取时不断搅拌等![]() ;
;![]() ;
;
![]() 溶于浓盐酸,铁离子、铋离子易发生水解,加入浓盐酸可溶解
溶于浓盐酸,铁离子、铋离子易发生水解,加入浓盐酸可溶解![]() ,同时防止
,同时防止![]() 和
和![]() 水解生成不溶性沉淀,从而提高原料的浸出率;母液中含有大量氯化亚铁,通入氯气后氯化亚铁氧化成氯化铁,氯化铁可循环利用,故答案为:溶解
水解生成不溶性沉淀,从而提高原料的浸出率;母液中含有大量氯化亚铁,通入氯气后氯化亚铁氧化成氯化铁,氯化铁可循环利用,故答案为:溶解![]() ,同时防止
,同时防止![]() 和
和![]() 水解生成不溶性沉淀,提高原料的浸出率;氯气;
水解生成不溶性沉淀,提高原料的浸出率;氯气;
![]() 金属Bi与氧气、过氧化钠焙烧生成,铋酸钠,该反应的化学方程式为
金属Bi与氧气、过氧化钠焙烧生成,铋酸钠,该反应的化学方程式为![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
![]() 当水中
当水中![]() :
:![]() :4时,也就是
:4时,也就是![]() 离子以络合物形式被萃取分离的百分率为
离子以络合物形式被萃取分离的百分率为![]() ,根据图象可知,此时废水的
,根据图象可知,此时废水的![]() ,故答案为:
,故答案为:![]() ;
;
![]() 向萃取后的
向萃取后的![]() 中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,该沉淀为
中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,该沉淀为![]() ,反应的离子方程式为:
,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 被还原为
被还原为![]() ,
,![]() 被氧化成成
被氧化成成![]() ,根据化合价升降相等配平可得:
,根据化合价升降相等配平可得:![]() ,亚铁离子与高锰酸根离子反应为:
,亚铁离子与高锰酸根离子反应为:![]() ,由反应
,由反应![]() 、
、![]() 可知,
可知,
![]()
![]() ,
,
5 10
![]()
![]()
![]()
该样品中![]() 纯度为:
纯度为:![]() ,故答案为:
,故答案为:![]() ;
; ![]() 。
。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示![]() 省略夹持和净化装置
省略夹持和净化装置![]() 仅用此装置和表中提供的物质完成相关实验,最合理的选项是
仅用此装置和表中提供的物质完成相关实验,最合理的选项是
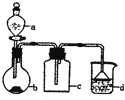
选项 | a中的物质 | b中的物质 | c中的物质 | d中的物质 |
A | 浓氨水 | NaOH |
|
|
B | 浓盐酸 |
|
| NaOH溶液 |
C | 稀硝酸 | Cu | NO |
|
D | 浓硫酸 |
|
| NaOH溶液 |
A.AB.BC.CD.D