��Ŀ����
����Ŀ��������Ļ������ڹ�ũҵ�����������о�����ҪӦ�á���ش��������⣺
(1)���������г���N2H4��Ϊ����������ȼ����N2H4�백�����ƣ���һ�ּ������壬������ˮ����������N2H4��H2O���õ��뷽��ʽ��ʾN2H4��H2O�Լ��Ե�ԭ���ǣ�____________________________________________��
(2)�ں��������£�1 mol NO2������C������Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
N2(g)+2CO2(g)�����ƽ��ʱNO2��CO2�����ʵ���Ũ����ƽ����ѹ�Ĺ�ϵ��ͼ��ʾ��
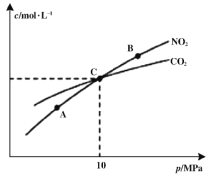
��A��B�����Ũ��ƽ�ⳣ����ϵ��Kc(A) ___________Kc(B)(�<����>����=��)
��A��B��C������NO2��ת������ߵ���___________(�A����B����C��)�㡣
������C��ʱ�÷�Ӧ��ѹǿƽ�ⳣ��Kp=___________MPa(Kp����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������)��
(3)��֪��������(HNO2)���ʺ��������ƣ�������һ�����ᡣ������������ĵ���ƽ�ⳣ��Ka=5.1��10��4��H2CO3��Ka1=4.2��10��7��Ka2=5.61��10��11���ڳ���������2mol̼���Ƶ���Һ�м���1mol��HNO2������Һ��CO32����HCO3����NO2��������Ũ���ɴ�С��˳����______________________��
(4)��֪�������¼װ�(CH3NH2)�ĵ��볣��ΪKb����pKb=��lgKb=3.4ˮ��Һ����CH3NH2+H2OCH3NH3++OH������������CH3NH2��Һ�μ�ϡ������c(CH3NH2)=c(CH3NH3+)ʱ������ҺpH=_______��
(5)һ��ú̿������������Ԫ����CaSO4���γɹ̶���������������CO�ֻ���CaSO4������ѧ��Ӧ����ص��Ȼ�ѧ����ʽ���£�
��CaSO4(s)+CO(g) CaO(s)+SO2(g)+CO2(g) ��H=+210.5kJ�� mol��1
��CaSO4(s)+4CO(g) CaS(s)+ 4CO2(g) ��H=��189.2 kJ�� mol��1
��ӦCaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g) ��H=___________ kJ�� mol��1
���𰸡�N2H4��H2O![]() N2H5++OH-����N2H4+H2O
N2H5++OH-����N2H4+H2O![]() N2H5++OH-�� = A 2 c(HCO3��)>c(NO2��)>c(CO32��) 10.6 -399.7
N2H5++OH-�� = A 2 c(HCO3��)>c(NO2��)>c(CO32��) 10.6 -399.7
��������
(1) N2H4���H2O�����������ʹ��Һ�ʼ��ԣ�
(2)��ƽ�ⳣ��ֻ���¶�Ӱ�죬�ݴ��жϣ�
������ѹǿƽ�������������С�ķ����ƶ���
����C��ʱ��������̼�����������Ũ����ȣ����ݷ�Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬�ݴ�ȷ�����ɷ�������������������ȷ����Ӧ��ѹǿƽ�ⳣ��Kp��
N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬�ݴ�ȷ�����ɷ�������������������ȷ����Ӧ��ѹǿƽ�ⳣ��Kp��
(3)������볣��Խ������Խǿ�����������ˮ��̶�ԽС��
(4) ����Kb=![]() =c(OH-)���㣻
=c(OH-)���㣻
(5) ���ø�˹���ɽ���-�ٿɵ�CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)��Ӧ�ȡ�
(1)��������ˮ�������백���Ƶ�������������OH-�������ӣ����뷽��ʽΪN2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
��ˣ�������ȷ���ǣ�N2H4��H2O![]() N2H5++OH-��
N2H5++OH-��
(2)��ƽ�ⳣ��ֻ���¶�Ӱ�죬����Kc(A) =Kc(B)��
��ˣ�������ȷ���ǣ�=��
������ѹǿƽ�������������С�ķ����ƶ����÷�Ӧ������Ӧ�������������ķ�Ӧ������A��B��C������NO2��ת������ߵ���A�㣬
��ˣ�������ȷ���ǣ�A��
����C��ʱ��������̼�����������Ũ����ȣ����ݷ�Ӧ2NO2(g)+2C(s)![]() N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬���Ի��������CO2���������Ϊ
N2(g)+2CO2(g)������֪��������Ũ��Ϊ������̼��һ�룬���Ի��������CO2���������Ϊ![]() ��NO2���������
��NO2���������![]() ��N2���������
��N2���������![]() �����Է�Ӧ��ѹǿƽ�ⳣ��Kp=
�����Է�Ӧ��ѹǿƽ�ⳣ��Kp=![]() =
= =2MPa��
=2MPa��
��ˣ�������ȷ���ǣ�2��
(3)2mol̼���Ƶ���Һ�м���1mol��HNO2�õ�����1mol̼���ơ�1mol̼�����ƺ�1mol�������ƵĻ��Һ����������ĵ���ƽ�ⳣ��Ka=5.1��10��4��H2CO3��Ka1=4.2��10��7��Ka2=5.61��10��11�����ж�ˮ��̶ȴ�С˳��ΪCO32��> NO2����CO32-ˮ������HCO3����ˮ��ij̶Ƚ�С��������Һ��CO32�����ӡ�HCO3�����Ӻ�NO2�����ӵ�Ũ�ȴ�С��ϵΪc(HCO3��)>c(NO2��)>c(CO32��)��
��ˣ�������ȷ���ǣ�c(HCO3��)>c(NO2��)>c(CO32��)��
(4)���볣��Kbֻ���¶ȸı䣬����ʱ��CH3NH2+H2OCH3NH3++OH�������μ�ϡ������c(CH3NH2)=c(CH3NH3+)ʱ��Kb=![]() =c(OH-)����c(OH-)= Kb=10-3.4mol/L����c(H+)=
=c(OH-)����c(OH-)= Kb=10-3.4mol/L����c(H+)=![]() =10-10.6������pH=-lg10-10.6=10.6��
=10-10.6������pH=-lg10-10.6=10.6��
��ˣ�������ȷ���ǣ�10.6��
(5) ���ø�˹���ɽ���-�ٿɵ�CaO(s)+3CO(g)+SO2(g) CaS(s)+3CO2(g)
��H=����189.2 kJ�� mol��1��-��+210.5kJ�� mol��1��=-399.7 kJ�� mol��1��
��ˣ�������ȷ���ǣ�-399.7��

 Сѧ�̲�ȫ��ϵ�д�
Сѧ�̲�ȫ��ϵ�д� Сѧ��ѧ������ѿڶ���ϵ�д�
Сѧ��ѧ������ѿڶ���ϵ�д� ������Ӧ�������������ϵ�д�
������Ӧ�������������ϵ�д� �㽭֮�ǿ�ʱ�Ż���ҵϵ�д�
�㽭֮�ǿ�ʱ�Ż���ҵϵ�д�����Ŀ�������仯�����ǿ�ѧ����һֱ��̽�������⣬�����ڹ�ũҵ�������������������Ҫ�����á��ش��������⡣
I.NOx��SO2�ڿ����д�������ƽ�⣺
2NO��g��+O2��g��2NO2��g����H=��113.0kJmol��1
2SO2��g��+O2��g��2SO3��g����H=��196.6kJmol��1
SO2ͨ���ڶ��������Ĵ����£���һ��������������SO3��
��1��д��NO2��SO2��Ӧ���Ȼ�ѧ����ʽΪ_________��
��2�����¶����ߣ��÷�Ӧ��ѧƽ�ⳣ���仯������_____��
II.��1��Ŀǰ��Ӧ��NH3�Ĵ���ԭ���������������������ѳ�����ѧ��Ӧ�ɱ�ʾΪ��2NH3(g)+NO(g)+NO2(g)== 2N2(g)+3H2O(g) ��H��0���÷�Ӧ�У���Ӧ��������_____(����>������<������=��)��������������
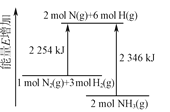
��2����֪4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) ��H=-1800 kJ��mol-1����2 mol NH3��3 mol NO�Ļ������ֱ�����a��b��c����10 L�����ܱ������У�ʹ��Ӧ�ڲ�ͬ�����½��У���Ӧ������c(N2)��ʱ��ı仯��ͼ��ʾ��
5N2(g)+6H2O(g) ��H=-1800 kJ��mol-1����2 mol NH3��3 mol NO�Ļ������ֱ�����a��b��c����10 L�����ܱ������У�ʹ��Ӧ�ڲ�ͬ�����½��У���Ӧ������c(N2)��ʱ��ı仯��ͼ��ʾ��
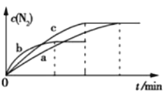
��������a�еķ�Ӧ��ȣ�����b�еķ�Ӧ�ı��ʵ������������_______���жϵ�������___________________��
��һ���¶��£�������˵����Ӧ�Ѵﵽƽ��״̬����____
A��H2O(g)��NO������������� B�����������ܶȱ��ֲ���
C����H���ֲ��� D����������ѹǿ���ֲ���
��3����NH3��Cl2��Ӧ�����Ʊ�����ǿ�����Ե����Ȱ������Ȱ������ԡ����Ի����лᷢ��ǿ��ˮ�⣬���ɾ���ǿɱ�����õ����ʣ�������ʽΪ3Cl2(g)+NH3(g)![]() NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
NCl3(l)+3HCl(g)�����ݻ���Ϊ1L�ļס����������£���Ӧ�¶ȷֱ�Ϊ400�桢T�棩�����зֱ����2molCl2��2molNH3����ø�������n(Cl2)�淴Ӧʱ��t�ı仯������±���ʾ��
t /min | 0 | 40 | 80 | 120 | 160 |
n(Cl2)(������)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(Cl2)(������)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
��T��__________400�棨����>������<������
�ڸ÷�Ӧ����H__________0������>������<������
�۸÷�Ӧ�Է����е�������__________������¡����¡��κ��¶ȣ���
�ܶԸ÷�Ӧ������˵����ȷ����_________����ѡ����ĸ����
A.�������������ܶȲ��䣬�������Ӧ�ﵽƽ��״̬
B.��������Cl2��NH3���ʵ���֮��Ϊ3��1���������Ӧ�ﵽƽ��״̬
C.��Ӧ�ﵽƽ��������������䣬��ԭ�����а�![]() ��������һ������Ӧ�����ƽ���Cl2��ת��������
��������һ������Ӧ�����ƽ���Cl2��ת��������
D.��Ӧ�ﵽƽ��������������䣬����һ������NC13��ƽ�⽫���淴Ӧ�����ƶ�