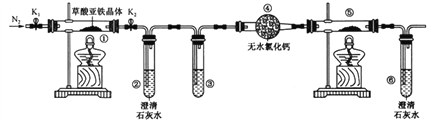
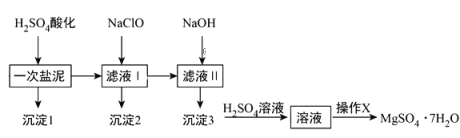
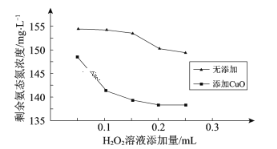
题目内容
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A. 18gD2O和18gH2O中含有的质子数均为10NA
B. 2L0.5mol/L亚硫酸溶液中含有的H+数为2NA
C. 42g乙烯和丙烯的混合气体充分燃烧消耗氧气的分子数为4.5 NA
D. 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
【答案】C
【解析】
A. 18gD2O中含有的质子的物质的量![]() ,18gH2O中含有的质子的物质的量
,18gH2O中含有的质子的物质的量![]() ,故A错误;
,故A错误;
B. 亚硫酸是弱电解质,不能完全电离,2L0.5mol/L亚硫酸溶液中含有的H+数小于2NA,故B错误;
C. 乙烯和丙烯最简式为CH2,根据CH2+(1+![]() )O2→CO2+H2O,42g乙烯和丙烯的混合气体耗氧量=
)O2→CO2+H2O,42g乙烯和丙烯的混合气体耗氧量=![]() 4.5 NA,故C正确;
4.5 NA,故C正确;
D. NO和O2反应方程式为2NO+O2=2NO2,根据方程式知,2molNO与1molO2恰好完全反应生成2molNO2,但NO2和N2O4之间存在转化,方程式2NO2N2O4,所以产物分子数小于2NA,故D错误。

【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同