题目内容
【题目】利用“化学计量在实验中的应用”的相关知识填空。
(1)含有6.02×1023个氧原子的H2SO4的物质的量是_______.
(2)与标准状况下VLCO2所含氧原子数目相同的水的质量是_______g(用分式表示)
(3)将4gNaOH溶解在10mL水中,再稀释成1L,从中取出10mL,这10mL溶液的物质的量浓度为________.
(4)在一定的温度和压强下,1体积X2(g)跟3体积Y2(g)化合生成2体积化合物,则该化合物的化学式是________.
(5)将50mL0.1molL1NaCl和50mL0.5molL1CaCl2溶液混合后,若溶液的体积为二者体积之和,则混合溶液中c(Cl)为_______.
(6)三种正盐的混合溶液中含有0.2molNa+、0.25molMg2+、0.4molCl和SO42,则n(SO42)为_________.
【答案】0.25mol ![]() 0.1mol/L XY3 0.55mol/L 0.15mol
0.1mol/L XY3 0.55mol/L 0.15mol
【解析】
(1)根据公式n=![]() 进行计算;
进行计算;
(2)根据公式N=nNA=![]() 进行计算;
进行计算;
(3)根据n=![]() 计算出氢氧化钠的物质的量,然后根据c=
计算出氢氧化钠的物质的量,然后根据c=![]() 计算出水配制的氢氧化钠溶液的浓度,然后根据溶液具有均一性可知取出的10mL氢氧化钠的溶液的浓度;
计算出水配制的氢氧化钠溶液的浓度,然后根据溶液具有均一性可知取出的10mL氢氧化钠的溶液的浓度;
(4)一定温度与压强下,气体的体积之比等于物质的量之比,等于化学计量数之比,然后利用质量守恒定律来确定化学式;
(5)先分别利用n=cV来计算溶液中溶质的物质的量,从而确定Cl-的物质的量,最后利用c=n÷V来计算混合液中Cl-的物质的量浓度;
(6)溶液中阴离子和阳离子的正负电荷守恒,根据守恒思想来计算。
(1)6.02×1023个氧原子,即氧原子的物质的量是1mol,所以H2SO4的物质的量是:![]() =0.25mol;
=0.25mol;
(2)标准状况下VL CO2所含氧原子数目是:![]() =
=![]() mol,含有氧原子说明相同,则含有氧原子的物质的量相等,则水的物质的量为
mol,含有氧原子说明相同,则含有氧原子的物质的量相等,则水的物质的量为![]() mol,水的质量为:18g·mol-1×
mol,水的质量为:18g·mol-1×![]() mol=
mol=![]() g;
g;
(3)将4g NaOH溶解在10mL水中,再稀释成1L,4g氢氧化钠的物质的量为:
![]() =0.1mol,稀释后溶液浓度为:
=0.1mol,稀释后溶液浓度为:![]() =0.1mol·L-1,从中取出10mL,由于溶液具有均一性,则这10mL溶液的物质的量浓度不变,仍然为0.1mol·L-1;
=0.1mol·L-1,从中取出10mL,由于溶液具有均一性,则这10mL溶液的物质的量浓度不变,仍然为0.1mol·L-1;
(4)一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物,设该化合物为Z,由气体的体积之比等于物质的量之比,等于化学计量数之比,
则X2+3Y2═2Z,由原子守恒可知,Z为XY3;
(5)NaCl的物质的量为:0.05L×0.1mol·L-1=0.005mol,CaCl2的物质的量为:0.05L×0.5mol·L-1=0.025mol,则混合液中Cl-的总物质的量为:0.005mol+0.025mol×2=0.055mol,所以混合液中Cl-的物质的量浓度为:![]() =0.55mol·L-1;
=0.55mol·L-1;
(6)溶液中阴离子和阳离子的正负电荷守恒,即n(Na+)+2n( Mg2+)=n (Cl-)+2n(SO42-),所以0.2 mol+2×0.25 mol=0.4 mol+2n(SO42-),解出n(SO42-)=0.15mol。

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
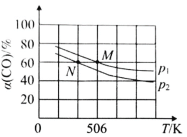
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。