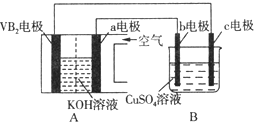
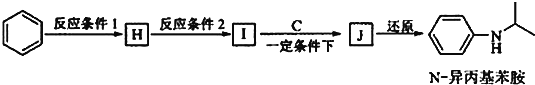
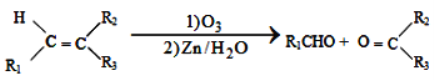题目内容
【题目】MgSO4·7H2O在医药上常用做泻药,工业上可用氯碱工业中的一次盐泥为原料生产已知一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分其主要工艺如下:
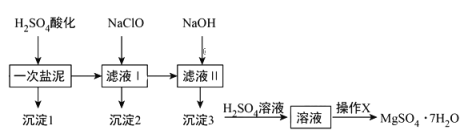
请回答下列问题:
(1)一次盐泥与H2SO4充分反应后,分离沉淀1与滤液I时所用到的玻璃仪器有玻璃棒和_____________.
(2)“操作X”是将溶液___________、___________、过滤洗涤,即得到MgSO4·7H2O晶体.
(3)加NaClO溶液至pH=5~6并加热煮沸5-10分钟,沉淀2中主要含有MnO2和另外两种难溶物,这两种难溶物的化学式分别为___________、___________;其中NaClO溶液将MnSO4转化为MnO2的离子方程式为________.
(4)称量制得的样品5g,用200mL水溶解,加入2mol/L的盐酸5mL,在不断搅拌下滴加足量2mol/LBaCl2溶液,充分反应后,得沉淀4.66 g,则样品纯度为_______。
【答案】烧杯 、漏斗 蒸发浓缩(或加热浓缩) 冷却结晶(或降温结晶) Fe(OH)3或Fe2O3 Al(OH)3或Al2O3 ClO-+Mn2++H2O=MnO2+Cl-+2H+ 98.4%
【解析】
一次盐泥中含有镁、钙、铁、铝、锰的硅酸盐和碳酸盐等成分,加入硫酸反应生成硫酸镁,硫酸钙,硫酸铁,硫酸铝,硫酸锰,会把碳酸盐和硅酸盐转化为溶于水的硫酸盐,得到的沉淀1主要为H2SiO3、CaSO4,过滤,滤液加入次氯酸钠是为了氧化锰离子为二氧化锰,同时溶液中Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,所以沉淀2为MnO2、Fe(OH)3、Al(OH)3,过滤,在滤液中加入氢氧化钠生成氢氧化镁沉淀,所以沉淀3为Mg(OH)2,氢氧化镁中加入硫酸得到硫酸镁溶液,将溶液经过加热浓缩,冷却结晶,过滤、洗涤、干燥等操作,获得MgSO47H2O晶体。
(1)分离沉淀1与滤液I属于过滤操作,则所用到的玻璃仪器有玻璃棒、烧杯和漏斗;
(2)硫酸镁溶液经过蒸发浓缩(或加热浓缩)、冷却结晶(或降温结晶)和过滤洗涤,即得到MgSO4·7H2O晶体;
(3)加入硫酸反应生成硫酸镁,硫酸铝,硫酸铁,加入次氯酸钠是为了氧化锰离子为二氧化锰,调节溶液pH,Fe3+、Al3+水解生成Fe(OH)3、Al(OH)3沉淀,受热分解分别得到Fe2O3和Al2O3;NaClO溶液在加热条件下将溶液中的Mn2+氧化成MnO2,反应的离子方程式为Mn2++ClO-+H2O=MnO2↓+2H++Cl-;
(4)准确称量制得的样品5g,用200mL水溶解,加入2molL-1的盐酸5mL,在不断搅拌下滴加足量2molL-1 BaCl2溶液,充分反应后,得沉淀4.66g,生成沉淀BaSO4物质的量=![]() =0.02mol,则MgSO47H2O物质的量为0.02mol,质量=0.02mol×246g/mol=4.92g,样品纯度=
=0.02mol,则MgSO47H2O物质的量为0.02mol,质量=0.02mol×246g/mol=4.92g,样品纯度=![]() 100%=98.4%。
100%=98.4%。

【题目】H2是一种重要的清洁能源。
(1)已知:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJmol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH3=-41.1kJmol-1
CO2(g)+H2(g) ΔH3=-41.1kJmol-1
H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
CH3OH(g) ΔH1,则ΔH1=___kJmol-1,该反应自发进行的条件为___
A.高温 B.低温 C.任何温度条件下
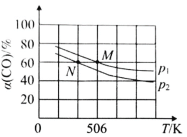
(2)恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2,发生反应CO(g)+2H2(g)![]() CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1__P2,判断的理由是_____。
(3)若反应 CO(g)+2H2(g)![]() CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
时间/min | 0 | 5 | 10 | 15 |
H2 | 4 | 2 | ||
CO | 2 | 1 | ||
CH3OH(g) | 0 | 0.7 |
①下列各项能作为判断该反应达到平衡标志的是____(填字母);
C.混合气体的相对分子质量保持不变 D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=___(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=___kPamin-1。