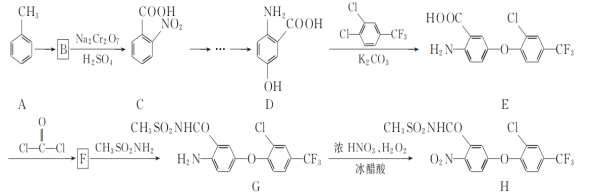
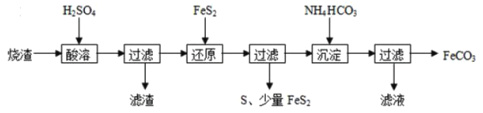
题目内容
【题目】NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.标准状况下,5.6L甲烷和乙烯的混合气体中所含碳氢键数为NA
B.足量镁与一定体积的浓硫酸反应,产生气体2.24L(标准状况),则转移的电子数为0.2NA
C.含7.8gNa2S的溶液中阴离子总数大于0.1NA
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液,则混和液中:N(CO32-)+N(HCO3-)+N(H2CO3)=0.1NA
【答案】D
【解析】
A. 标准状况下,5.6L甲烷和乙烯的混合气体的物质的量![]() ,而无论是甲烷还是乙烯中,一个分子所含碳氢键数都为4个,故0.25mol混合气体无论比例如何,所含碳氢键数均为NA,A正确;
,而无论是甲烷还是乙烯中,一个分子所含碳氢键数都为4个,故0.25mol混合气体无论比例如何,所含碳氢键数均为NA,A正确;
B. 足量镁与一定体积的浓硫酸反应时,由于镁足量,硫酸要反应完,产生气体为二氧化硫和氢气的混合气体,体积为2.24L(标准状况),总物质的量为0.1mol,产生二氧化硫时,硫由+6价变为+4价,生成1mol二氧化硫转移2mol电子,产生氢气是,2mol氢离子产生1mol氢气,转移电子仍为2mol,即转移电子的物质的量为气体的2倍,故生成0.1mol混合气体,转移的电子数为0.2NA,B正确;
C. 7.8gNa2S的物质的量![]() ,S2-总数为0.1NA ,而在水溶液中,S2-水解产生HS-和OH-,溶液中阴离子总数变多,所以大于0.1NA,C正确;
,S2-总数为0.1NA ,而在水溶液中,S2-水解产生HS-和OH-,溶液中阴离子总数变多,所以大于0.1NA,C正确;
D.向100mL1molL-1稀盐酸中逐滴加入含0.1molNa2CO3的溶液时,开始时,稀盐酸过量,立即有二氧化碳放出,根据物料守恒,混合液中:N(CO32-)+N(HCO3-)+N(H2CO3)<0.1NA,D错误。
答案选D。

练习册系列答案
相关题目