题目内容
【题目】我国自主知识产权的首套煤基乙醇工业化项目的生产过程:先用煤制得乙酸甲酯,再将乙酸甲酯转化为乙醇。乙酸甲酯转化为乙醇涉及反应原理:
主反应:CH3COOCH3(g)+2H2(g)![]() C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
C2H5OH(g)+CH3OH(g) ΔH1=-23.61kJmol-1
副反应:CH3COOCH3(g)+C2H5OH(g)![]() CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
CH3COOC2H5(g)+CH3OH(g) ΔH2=0.99kJmol-1
在催化剂作用下的反应历程为(*表示吸附态)
化学吸附:H2→2H*
表面反应:CH3COOCH3+4H*→CH3CH2OH*+CH3OH*
化学脱附:CH3CH2OH*→CH3CH2OHCH3OH*→CH3OH
已知:化学吸附的活化能大,决定主反应的反应速率。
(1)2CH3COOCH3(g)+2H2(g)![]() CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
CH3COOC2H5(g)+2CH3OH(g) ΔH3则ΔH3=___。
(2)下列条件,有利于提高C2H5OH平衡产率的是___。
A.低温 B.高温 C.低压 D.高压 E.催化剂
(3)在1L密闭容器中充入1mol乙酸甲酯,乙酸甲酯的平衡转化率与温度和氢酯比(x)[x=![]() ]的关系如图1。
]的关系如图1。
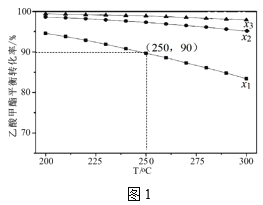
①x1、x2、x3的大小关系为___。
②250℃、x1=10,C2H5OH的选择性为60%,则主反应的平衡常数为___(保留2位有效数字)。(如乙醇选择性=![]() )
)
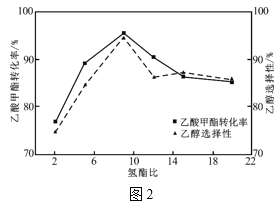
(4)其它条件相同,反应经过相同时间,乙酸甲酯的转化率与乙醇的选择性随氢酯比的关系如图2所示。氢酯比(x)在2~9之间,乙醇的选择性逐渐增大的原因为___。
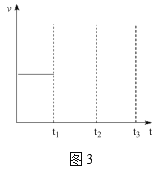
(5)若仅发生主反应,在恒压条件下,充入乙酸甲酯和氢气各2mol一段时间后达平衡,若在t1时刻再充入各1mol的反应物(其它条件不变),t2时重新达到平衡,请在图3中画出t1~t3的正逆反应速率变化的示意图。___。
【答案】ΔH=-22.62kJ·mol-1 AD x3>x2>x1 0.061 氢气的化学吸附是决速步,增大氢气浓度加快整体化学反应速率,且副反应的速率增大幅度小于主反应,所以乙醇的选择性增大 
【解析】
(1)根据盖斯定律进行求算;
(2)根据影响化学平衡的因素进行分析;
(3)根据图象中平衡转化率分析充入氢气的量,比较三个氢酯比大小;通过乙酸甲酯的平衡转化率计算最终转化为乙醇的乙酸甲酯的物质的量,进而求算化学平衡常数;
(4)根据氢酯比增大,反应速率加快的角度回答;
(5)根据恒温恒压下的等效平衡原理进行分析。
(1)根据盖斯定律,将已知反应1和2相加即得到目标反应,反应热ΔH3=ΔH1+ΔH2=-22.62 kJ·mol-1;
(2)该反应为放热反应,若需要提高甲醇的产率则需要将平衡正向移动;降低反应温度,反应向放热方向移动(即正反应方向),可增大甲醇产率;适当增大压强,反应向气体系数和小的方向移动(即正反应方向),可增大甲醇的产率;加入催化剂可以增大化学反应速率但不影响化学平衡,故答案选择AD;
(3)①根据图象可以知道,x3的平衡转化率最高x1的平衡转化率最低,说明在充入相同乙酸甲酯时,充入的氢气量x3最大,氢气量越大,乙酸甲酯的平衡转化率就越大,x为氢酯比,故x3>x2>x1;
②250℃时,乙酸甲酯的平衡转化率为90%,即反应的0.9mol的乙酸甲酯,根据乙醇的选择性可以计算最后有0.54mol的乙酸甲酯最终转化为乙醇,剩余的0.36mol乙酸甲酯参与了副反应,主反应过程中生成乙醇0.54mol、甲醇0.54mol,消耗氢气1.12mol,剩余氢气8.92mol,副反应过程中生成甲醇0.36mol,故平衡时c(CH3COOCH3)=0.1mol/L,c(H2)=8.92mol/L,c(C2H5OH)=0.54mol/L,c(CH3OH)=0.9mol/L,主反应的平衡常数K=![]() =
=![]() =0.061;
=0.061;
(4)氢酯比在2-9之间,乙醇的选择性逐渐增大,其原因是:氢气的化学吸附是决速步,增大氢气浓度加快整体化学反应速率,且副反应的速率增大幅度小于主反应,所以乙醇的选择性增大;
(5)在恒压条件下反应,再充入各1mol反应物,反应物的浓度增大,正反应速率加快,生成物浓度减小,逆反应速率减慢;因同时加入等量的反应物与初始状态投入的各反应物的比相同,为等效反应,故新的平衡达到时正逆反应速率与原平衡正逆反应速率相同,t1-t3段的图象为 。
。

 阅读快车系列答案
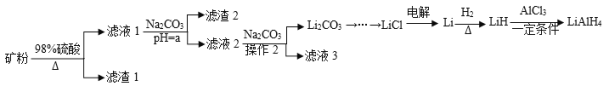
阅读快车系列答案【题目】四氢铝锂(LiAlH4)常作为有机合成的重要还原剂。工业上以辉锂矿(主要成分是LiAlSi2O6,含少量Fe2O3)为原料合成四氢铝锂的流程如图:
已知:金属氢氧化物沉淀的pH如下表所示:
物质 | Fe(OH)3 | Al(OH)3 |
开始沉淀的pH | 2.3 | 4 |
完全沉淀的pH | 3.7 | 6.5 |
请回答:
(1)写出LiAlSi2O6与硫酸反应的化学方程式__。滤渣2的主要成分为__(填化学式),“a”的最小值为__。
(2)已知Li2CO3微溶于水,其饱和溶液的浓度与温度关系如下表所示。操作2中,蒸发浓缩后必须趁热过滤,其原因是__,90℃时Ksp(Li2CO3)的值为__。
温度/℃ | 10 | 30 | 60 | 90 |
浓度/mol·L-1 | 0.21 | 0.17 | 0.14 | 0.10 |
(3)流程中由LiC1制备金属Li的电解条件是__。
(4)为测定制备的四氢铝锂(LiAlH4)的纯度,称取样品ag加入水使其完全反应后,收集到标况下气体VmL,
①LiAlH4溶解时发生反应的化学方程式为__。
②样品的纯度为__(列出数学表达式即可)。