题目内容
7.下列说法或表示方法正确的是( )| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+119 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
分析 A、硫蒸气变化为硫固体为放热过程;
B、物质的能量越低越稳定;
C、浓硫酸溶于水放热;
D、2g氢气燃烧放热285.8KJ,4g氢气燃烧放热应更多.
解答 解:A、硫蒸气变化为硫固体为放热过程,则等量的硫蒸气和硫固体在氧气中分别完全燃烧,放出热量硫蒸气多,即前者放出热量多,故A错误;
B、石墨能量比金刚石低,石墨稳定,故B错误;
C、浓硫酸溶于水放热,所以0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,整个过程放出的热量大于57.3 kJ,故C正确;
D、2g氢气燃烧放热285.8KJ,4g氢气燃烧放热应为2×285.8KJ=571.6KJ,故D错误;
故选C.
点评 本题考查了化学反应中的能量变化,燃烧热、中和热的概念,属于基础知识的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列化学用语表述不正确的是( )
| A. | HC1的电子式: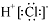 | B. | CH4的球棍模型: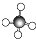 | ||
| C. | S2-的结构示意图: | D. | 乙烯的结构简式:CH2═CH2 |
2.下列叙述中,错误的是( )
| A. | 苯与浓硝酸、浓硫酸共热并保持50-60℃反应生成硝基苯 | |
| B. | 苯乙烯在合适条件下催化加氢可生成乙基环己烷 | |
| C. | 乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷 | |
| D. | 甲苯与氯气在光照下反应主要生成2,4,6-三氯甲苯 |
19.加入NaOH溶液后,溶液中哪种离子数目不会减少( )
| A. | NH4+ | B. | Mg2+ | C. | SO42- | D. | HCO3- |
16.常温下,下列物质不能用铁制容器盛装的是( )
| A. | 稀盐酸 | B. | 氢氧化钠溶液 | C. | 浓硫酸 | D. | 浓硝酸 |
 羧基,溴原子,醛基.
羧基,溴原子,醛基.