题目内容
16.常温下,下列物质不能用铁制容器盛装的是( )| A. | 稀盐酸 | B. | 氢氧化钠溶液 | C. | 浓硫酸 | D. | 浓硝酸 |
分析 根据铁的性质进行解答,能持续发生反应则不能用铁制容器来盛放,浓硫酸、浓硝酸具有强氧化性,铁在浓硫酸、浓硝酸中被氧化生成致密的氧化膜,阻止反应进一步进行,发生钝化,能盛放.铁和碱不反应,盐酸是非强氧化性的酸,能和铁反应,不能用铝制品容器盛放.据此分析解答.
解答 解:A.盐酸是弱氧化性的酸,浓盐酸能和铁反应生成氢气,不能用铁制品容器盛放,故A选;
B.铁和氢氧化钠溶液不反应,所以能用铁制容器盛装,故B不选;
C.常温下,铁在浓硫酸中发生钝化现象,故铁制品容器可以盛放浓硫酸,故C不选;
D.常温下,铁在浓硝酸中发生钝化现象,故铁制品容器可以盛放浓硝酸,故D不选.
故选A.
点评 本题考查了铁的化学性质,铁能和浓硫酸、浓硝酸在常温下发生钝化现象,所以可用铁制容器盛放浓硫酸、浓硝酸,题目难度不大.

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
7.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+119 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
11.对反应:CuSO4+FeS2+H2O→Cu2S+FeSO4+H2SO4,下列说法正确的是( )
| A. | 氧化剂只有CuSO4 | |
| B. | FeS2既是氧化剂又是还原剂 | |
| C. | 被氧化的硫和被还原的硫的质量比为3:7 | |
| D. | 1molCuSO4可氧化$\frac{5}{7}$mol的硫 |
1. 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c (Na+)+c (H+)=2c (CO32-)+c (OH-)+c (Cl-) | |
| B. | pH=4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol•L-1 | |
| C. | pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)=c (OH-)+c (Cl- ) | |
| D. | pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3) |
8.反应C(s)+H2O(g)CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 加入少量的C(s)粉 | B. | 将C(s)粉碎成细小粉末 | ||
| C. | 体积可变,充入氩气 | D. | 保持体积不变,充入氢气 |
5.半导体生产中常需要控制掺杂,以保证控制电阻率.三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
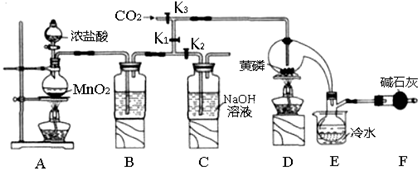
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生 成 H3PO3和HC1.遇O2会生成P0Cl3,P0Cl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓HSO4,E中冷水的作用是冷凝PCl3防止其挥发F中碱石灰的作用是吸收多余的氯气,防止空气中的水和PCl3反应
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生 成 H3PO3和HC1.遇O2会生成P0Cl3,P0Cl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓HSO4,E中冷水的作用是冷凝PCl3防止其挥发F中碱石灰的作用是吸收多余的氯气,防止空气中的水和PCl3反应
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
 硝酸工业产生的尾气以及汽车排放出的尾气中含有氮氧化物(NOx).
硝酸工业产生的尾气以及汽车排放出的尾气中含有氮氧化物(NOx). 表中所示物质或概念间的从属关系符合图示的是( )
表中所示物质或概念间的从属关系符合图示的是( ) .
.