题目内容
17.下列变化过程,属于放热反应的是( )①液态水变成水蒸气
②酸碱中和反应
③金属钠与水的反应
④氧化钙与二氧化碳的反应
⑤H2在Cl2中燃烧
⑥熟石灰与氯化铵的反应.
| A. | ②③④⑤ | B. | ②③④ | C. | ②⑤ | D. | ①③⑤ |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:①液态水变成水蒸气是吸热的物理过程,故①错误;
②酸碱中和反应是放热反应,故②正确;
③金属钠与水的反应是活泼金属与水的反应,是放热反应,故③正确;
④氧化钙与二氧化碳的反应为化合反应,是放热反应,故④正确;
⑤所有的燃烧均为放热反应,故H2在Cl2中燃烧是放热反应,故⑤正确;
⑥熟石灰与氯化铵的反应是吸热反应,故⑥错误.
故选A.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+119 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
8.反应C(s)+H2O(g)CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 加入少量的C(s)粉 | B. | 将C(s)粉碎成细小粉末 | ||
| C. | 体积可变,充入氩气 | D. | 保持体积不变,充入氢气 |
5.半导体生产中常需要控制掺杂,以保证控制电阻率.三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
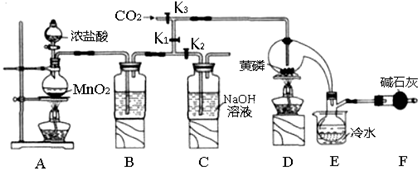
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生 成 H3PO3和HC1.遇O2会生成P0Cl3,P0Cl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
请回答下列问题:
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓HSO4,E中冷水的作用是冷凝PCl3防止其挥发F中碱石灰的作用是吸收多余的氯气,防止空气中的水和PCl3反应
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5 PCl3遇水会强烈水解生 成 H3PO3和HC1.遇O2会生成P0Cl3,P0Cl3溶于PCl3,PCl3、POCl3的熔沸点见下表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)A装置中制氯气的离子方程式为MnO2+4H++2Cl-$\frac{\underline{\;加热\;}}{\;}$Mn2++Cl2↑+2H2O.
(2)B中所装试剂是浓HSO4,E中冷水的作用是冷凝PCl3防止其挥发F中碱石灰的作用是吸收多余的氯气,防止空气中的水和PCl3反应
(3)实验时,检査装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POCl3、PCl5等.加入黄磷加热除去PCl5后.通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)通过下面方法可测定产品中PCl3的质量分数
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol•L-1碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol•L-1的Na2S2O3,溶液滴定
③重复②、③操作,平均消耗Na2S2O3,溶液8.40ml
已知:H3PO3+H2O+I2═H3PO4+2HI,I2+2Na2S2O3═2NaI+Na2S4O6,假设测定过程中没有其他反应.根据上述数据,该产品中PC13的质量分数为79.75%.
12.某矿石的主要成分由前20号元素中的W、Y、Z、X四种组成.X、Y、Z、W分布在三个周期,其原子序数依次增大,W、Y为金属元素,X原子的最外层电子数是此外层电子数的3倍,W能与冷水剧烈反应,Y、Z原子的最外层电子数之和与X、W原子的最外层电子数之和相等,Y、Z位于同周期,Z的单质是一种良好的半导体,下列说法正确的是( )
| A. | W、X、Y、Z的原子半径依次减小 | |
| B. | 气态氢化物的稳定性:Z>X | |
| C. | Y、Z的氧化物都既能跟酸反应又能和碱反应,所以均为两性氧化物 | |
| D. | 该矿石的主要成分的化学式可能为:WYZ3X8 |
9.有一工业废水,其中含有少量Fe2+、Ag+、Na+和SO42-.试设计一个实验方案,回收Ag并获得FeSO4•7H2O.请填写下表.
| 实验步骤 | 主要操作过程 | 离子方程式 |
| (1) | ||
| (2) | 过滤,得到不溶物和滤液 | |
| (3) | ||
| (4) | ||
| (5) | 将滤液合并,蒸发浓缩,析出晶体 | |
| (6) | , |
7.离子键的强弱主要决定于离子半径和离子电荷数,一般规律是:离子半径小,离子所带电荷值大,则离子键越强.①K2O ②MgO ③CaO三种物质离子键由强到弱的顺序是( )
| A. | K2O、MgO、CaO | B. | MgO、CaO、K2O | C. | MgO、K2O、CaO | D. | CaO、K2O、MgO |
 .
.