题目内容
18.如图是实验室制取、提纯氯气及研究氯气性质的装置图.请回答:(1)实验室制备氯气的化学反应方程式为4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑,此反应属于氧化还原反应,其氧化剂为二氧化锰,反应中浓盐酸表现的性质有酸性性和还原性性,且物质的量之比为1:1.
(2)反应一段时间后,若D瓶中装有碘化钾-淀粉溶液,则观察到的现象是溶液变蓝,原因是氯气氧化碘化钾生成单质碘,碘与淀粉变蓝
(3)E装置的溶液是氢氧化钠溶液,作用是吸收过量的氯气,写出E装置中发生化学反应的离子方程式Cl2+2OH-=Cl-+ClO-+H2O
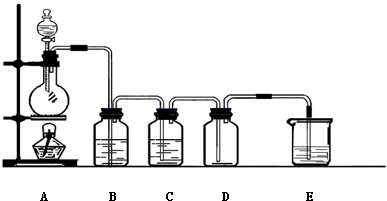
分析 (1)实验室用二氧化锰与浓盐酸加热制备氯气,依据反应中元素化合价变化判断是否是氧化还原反应,氧化还原反应中所含元素化合价升高的为还原剂,所含元素化合价降低为氧化剂,结合方程式判断解答;
(2)氯气氧化性强于碘,能够置换碘,碘遇到淀粉变蓝;
(3)氯气有毒,直接排放能引起环境污染,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸和水,可以用氢氧化钠溶液吸收过量的氯气.
解答 解:(1)实验室用二氧化锰与浓盐酸加热制备氯气,化学方程式:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑从方程式可知,反应中锰元素化合价降低,所以二氧化锰为氧化剂,氯化氢中有1半氯离子化合价升高,氯化氢既表现还原性,又表现酸性,该反应为氧化还原反应;
故答案为:4HCl(浓)+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑;氧化还原;二氧化锰;酸性;还原性;1:1;
(2)氯气氧化性强于碘,能够置换碘,碘遇到淀粉变蓝;
故答案为:溶液变蓝;氯气氧化碘化钾生成单质碘,碘与淀粉变蓝;
(3)氯气有毒,直接排放能引起环境污染,氯气能够与氢氧化钠溶液反应生成氯化钠、次氯酸和水,可以用氢氧化钠溶液吸收过量的氯气,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O;
故答案为:氢氧化钠溶液;吸收过量的氯气;Cl2+2OH-=Cl-+ClO-+H2O.
点评 本题考查了氯气的制备和性质的检验,熟悉氯气制备原理是解题关键,题目难度不大.

练习册系列答案
 全能测控期末小状元系列答案
全能测控期末小状元系列答案
相关题目
8.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | (CH3)2CHOH | C. | CH3CH2OCH2CH3 | D. | HCOOCH2CH2OOCH |
9.下列有关电解原理的说法正确的是( )
①电解质溶液中的阴离子移向电解池的阳极
②电解池的阳极发生还原反应
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理也不能实现
⑤任何溶液被电解时,必须导致氧化还原反应的发生.
①电解质溶液中的阴离子移向电解池的阳极
②电解池的阳极发生还原反应
③电解质溶液导电是化学变化,金属导电是物理变化
④不能自发进行的氧化还原反应,通过电解的原理也不能实现
⑤任何溶液被电解时,必须导致氧化还原反应的发生.
| A. | ①③⑤ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
13.在体积为VL的密闭容器中存在化学平衡:2NO2(g)?N2O4(g)△H<0.保持温度不变,将容器体积压缩至V$\frac{V}{2}$后,下列说法不正确的是( )
| A. | 容器内气体颜色变深 | B. | 容器内NO2分子数减少 | ||
| C. | 混合气体的平均相对分子质量增大 | D. | NO2的物质的量分数增大 |
3.下列实验方案正确的是( )
| A. | 证明溴乙烷中溴元素的存在:向溴乙烷中加入NaOH溶液,共热,冷却后加入AgNO3溶液,产生浅黄色沉淀 | |
| B. | 银氨溶液的配制:向1mL 2%的稀氨水中逐滴滴加2%的AgNO3溶液 | |
| C. | 苯甲酸的提纯:将1g粗苯甲酸放到100mL的烧杯里,加入50mL水,加热完全溶解后趁热过滤,静置冷却可析出苯甲酸晶体 | |
| D. | 除去苯中的苯酚杂质:向混有苯酚的苯中加入浓溴水,产生白色沉淀,再过滤 |
10.煤化工中两个重要反应为:
①C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ•mol-1,
②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为0.04mol/(L•min).
②CO(g)和H2O(g)反应的△H小于0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡向正反应方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
①C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ•mol-1,
②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡向正反应方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
7.下列说法或表示方法正确的是( )
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(s,石墨)═C(s,金刚石)△H=+119 kJ•mol-1可知,金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的稀溶液混合,放出的热量大于57.3 kJ | |
| D. | 在25℃、101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8 kJ•mol-1 |
8.反应C(s)+H2O(g)CO(g)+H2(g),在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
| A. | 加入少量的C(s)粉 | B. | 将C(s)粉碎成细小粉末 | ||
| C. | 体积可变,充入氩气 | D. | 保持体积不变,充入氢气 |
 硝酸工业产生的尾气以及汽车排放出的尾气中含有氮氧化物(NOx).
硝酸工业产生的尾气以及汽车排放出的尾气中含有氮氧化物(NOx).