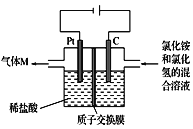
题目内容
【题目】某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,得到有色沉淀Y和弱碱性溶液Z;
②沉淀Y与![]() 溶液作用,无变化。
溶液作用,无变化。
下列说法不正确的是( )
A.混合物X中必定含有![]() ,不含
,不含![]()
B.溶液Z中溶质主要是钠盐,且必含![]()
C.灼烧沉淀Y,可能得到黑色物质
D.往溶液Z中加入Cu粉,若不溶解,说明X中不含![]()
【答案】D
【解析】
某固体混合物X,含有![]() 、
、![]() 、
、![]() 和
和![]() 中的几种,进行如下实验:
中的几种,进行如下实验:
①X与水作用有气泡冒出,四种物质中能生成气体的只有![]() ,所以一定有
,所以一定有![]() ,而几种物质中没有酸,可知推测因为发生双水解生成了二氧化碳,能与
,而几种物质中没有酸,可知推测因为发生双水解生成了二氧化碳,能与![]() 在溶液中双水解的有
在溶液中双水解的有![]() 、
、![]() 和
和![]() ;得到有色沉淀Y,则Fe(OH)3、Cu(OH)2中至少有一种Al(OH)3不确定;弱碱性溶液Z,说明溶液中不存在铝离子、铁离子和铜离子;
;得到有色沉淀Y,则Fe(OH)3、Cu(OH)2中至少有一种Al(OH)3不确定;弱碱性溶液Z,说明溶液中不存在铝离子、铁离子和铜离子;
②沉淀Y与![]() 溶液作用,无变化说沉淀中没有Al(OH)3,则X中一定没有
溶液作用,无变化说沉淀中没有Al(OH)3,则X中一定没有![]() ,据此再结合选项分析。
,据此再结合选项分析。
A. 根据分析可知混合物X中必定含有![]() ,不含
,不含![]() ,故A正确;
,故A正确;
B.溶液Z显弱碱性,所以大量存在的阳离子只能是钠离子,碳酸钠的水解分两步:CO32-+H2O=HCO3-+OH-;HCO3-+ H2O =H2CO3+OH-;由于发生双水解反应产生了二氧化碳且溶液显碱性说明溶液中依然存在第二步水解,第一步水解有可能存在,即溶液中一定有碳酸氢根,所以溶液Z中溶质主要是钠盐,且必含![]() ,故B正确;
,故B正确;
C.沉淀Y中可能含有氢氧化铜,故灼烧可以得到黑色固体,故C正确;
D.溶液Z显弱碱性,一定不存在![]() ,故D错误;
,故D错误;
故答案为D。

【题目】下列根据实验事实得出的结论正确的是
实验事实 | 结论 | |
A | 某物质在熔融态下能导电 | 该物质一定是电解质 |
B | 某溶液中加入BaCl2溶液有白色沉淀生成 | 该溶液中一定含有SO42- |
C | SO2的水溶液能导电 | SO2为电解质 |
D | 已知:Cl2+2FeCl2=2FeCl3反应能发生 | 氧化性:Cl2>FeCl3 |
A.AB.BC.CD.D