题目内容
【题目】氯气是一种重要的化工原料,在生产生活中有广泛的应用。
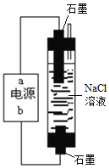
(1)一种环保型家用“84”消毒液的发生装置如右图,电源的b极为________极,电解制取NaClO的离子反应方程式为_______。
(2)用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g) ![]() COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
COCl2(g) H=-108 kJ·mol-1。t℃时,在5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示。
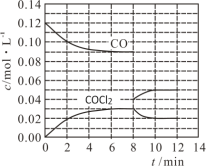
在0~6 min内υ(Cl2)=____________________,第8 min时改变的条件是________________。在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将________(填“增大”“不变”或“减小”)。
(3)氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25℃时氯气——氯水体系中存在以下平衡关系:
![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
HClO ![]() H+ + ClO- Ka
H+ + ClO- Ka
其中Cl2(aq)、HClO和ClO-分别在三者中所占分数(α)随pH变化的关系如图所示。
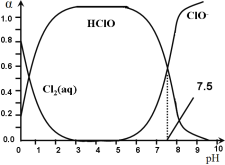
则①Ka = __________;
②Cl2(g) + H2O ![]() HClO + H+ +Cl- K = __________;
HClO + H+ +Cl- K = __________;
③用氯处理饮用水时,pH=6.5时杀菌效果比pH=7.5时___(填“好”、“差”或“相同”)。
【答案】正 Cl- + H2O![]() ClO-+H2↑或2Cl- + 2H2O
ClO-+H2↑或2Cl- + 2H2O![]() 2OH-+H2↑+Cl2↑、Cl2+2OH- = ClO- + Cl- + H2O 0.005 mol ·L-1·min-1 减小CO的浓度(或分离出一定量CO) 减小 10-7.5 10-4.6 好
2OH-+H2↑+Cl2↑、Cl2+2OH- = ClO- + Cl- + H2O 0.005 mol ·L-1·min-1 减小CO的浓度(或分离出一定量CO) 减小 10-7.5 10-4.6 好
【解析】
(1)在电解池的阴极上是阳离子得电子发生得电子的还原反应,在阳极上是阴离子发生失电子的氧化反应,制备消毒液,氯气可以和强碱反应生成氯化钠、次氯酸钠和水,b为正极,电解食盐水生成NaOH、氢气、氯气,氯气与NaOH反应生成NaClO;
(2)根据图像可分析出CO和COCl2的浓度在不同时刻的变化状况,三行式运算即可,根据图象观察第8 min时CO、COCl2浓度变化,判断改变条件,根据勒夏特略原理分析平衡移动方向得出结论;
(3)①分析图象知,选特殊的点,pH=7.5,此时c(HClO)=c(ClO-),计算Ka值 ;
②利用盖斯定律找出K与K1、K2、Ka的关系,以此计算;
③HClO的杀菌能力比ClO-强,所以HClO的浓度越大,其杀菌效果越好。
(1)制备消毒液,应产生氯气,让它和强氧化钠反应生成氯化钠、次氯酸钠和水,所以,氯气应该在下端生成,下端为阳极生成氯气,b为正极,a为负极,电解食盐水生成NaOH、氢气、氯气,氯气与NaOH反应生成NaClO,则电解饱和食盐水制备84消毒液(NaClO溶液)的离子方程式为 Cl- + H2O![]() ClO-+H2↑或2Cl- + 2H2O
ClO-+H2↑或2Cl- + 2H2O![]() 2OH-+H2↑+Cl2↑ Cl2+2OH- = ClO- + Cl- + H2O;
2OH-+H2↑+Cl2↑ Cl2+2OH- = ClO- + Cl- + H2O;
(2) 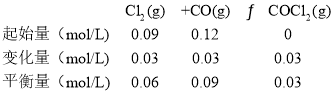
在0~6 min内v(Cl2)=△c /△t =(0.03mol/L)/ (6min) =0.005mol/(Lmin),
由图象可知第8 min时CO的浓度增大,但比原平衡小,且COCl2浓度减小,平衡逆向移动,所以改变的条件为减小CO的浓度(或分离出一定量CO),正反应为放热反应,升高温度平衡逆向移动,则COCl2的体积分数将减小;
(3)①由图象知,HClOH++ClO-中pH=7.5,此时c(HClO)=c(ClO-),![]() ;
;
Ⅰ.![]() Cl2(g)
Cl2(g) ![]()
![]() Cl2(aq) K1=10-0.6
Cl2(aq) K1=10-0.6
Ⅱ.Cl2(aq) + H2O![]() HClO + H+ +Cl- K2=10-3.4
HClO + H+ +Cl- K2=10-3.4
根据盖斯定律可得到:Ⅰ×2+Ⅱ可得Cl2(g)+H2OHClO+H++Cl- K,所以K=K12×K2=(10-0.6)2×10-3.4=10-4.6;
③起杀菌作用的是HClO,由图象可知,pH=6.5时c(HClO)比H=7.5时要大,HClO浓度越大,杀菌效果好,所以pH=6.5时杀菌效果比pH=7.5时好。

 阅读快车系列答案
阅读快车系列答案