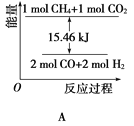
题目内容
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据下图所示,回答下列问题:
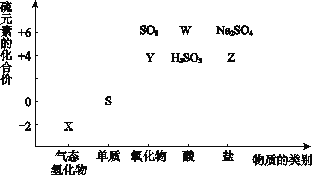
(1)Y的化学式为_________,检验Y所用的试剂是________________。
(2)W的浓溶液与铜单质在加热条件下可以发生化学反应,反应的化学方程式为__________________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是_______(填序号)。
a.Na2S + S b.Na2SO3 + S c.Na2SO3 + Na2SO4d.SO2 + Na2SO4
(4)将X与SO2混合,可生成淡黄色固体。该反应的氧化剂与还原剂的物质的量之比为__________。
【答案】SO2 品红溶液 Cu + 2H2SO4(浓)![]() CuSO4+ 2H2O + SO2↑ b 1∶2
CuSO4+ 2H2O + SO2↑ b 1∶2
【解析】
(1)根据+6价的形式,Y应是+4价的氧化物,即SO2,因为SO2能使品红溶液褪色,因此检验SO2时,常用品红溶液;
(2)W是H2SO4,浓硫酸具有强氧化性,与铜发生反应,Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)Na2S2O3中S的价态为+2价,根据氧化还原反应中不同价态的同种元素参加氧化还原反应,向中间价态靠拢,
a、S的价态分别是-2、0,不符合,故错误;
b、S的价态分别是+4价、0价,符合题目,故正确;
c、S的价态分别显+4价、+6价,不符合,故错误;
d、S的价态+4价、+6价,不符合,故错误;
(4)X为H2S,两者发生氧化还原反应,2H2S+SO2=3S+2H2O,因此氧化剂和还原剂的物质的量比值为1:2。

【题目】已知:CO(g) + H2O(g) ![]() H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
H2(g) + CO2(g) 的平衡常数K随温度的变化如下表,下列说法正确的是( )
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 恒温时增大压强,正反应速率增大
C. 830℃时,反应达到平衡,一定是c(CO)=c(CO2)
D. 400℃时,生成CO2物质的量越多,平衡常数K越大