题目内容
3.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)④和③形成含有非极性共价键的离子化合物的电子式

(7)元素②的氢化物的结构式为
 ;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
分析 由元素在周期表中位置,知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,
(1)稀有气体最外层电子满足稳定结构,元素⑩为Br,据此解答即可;
(2)非金属性越强,最高价含氧酸的酸性越强;金属性越强,最高价氧化物对应水化物的碱性越强;
(3)④与⑥形成的化合物为Na2S,由钠离子与硫离子构成,用Na原子、S原子电子式表示其形成;
(4)四氯化碳为共价化合物,所有原子均满足最外层8个电子的稳定结构;不同种原子之间形成极性共价键;
(5)电子层数越多,半径越大,相同核外电子排布的离子,原子序数越小,半径越大;
(6)Na与O可以形成氧化钠和过氧化钠,过氧化钠中含有非极性共价键;
(7)N的氢化物为氨气,氨气中N与H分别形成1对共价键,氨气与硝酸反应生成硝酸铵.
解答 解:由元素在周期表中位置,知①为C、②为N、③为O、④为Na、⑤为Al、⑥为S、⑦为Cl、⑧为Ar、⑨为K、⑩为Br,
(1)稀有气体Ar原子最外层有8个电子,为稳定结构,化学性质最不活泼,原子结构示意图为: ,元素⑩为Br元素,名称是溴,处于周期表中第第周期第VIIA族,故答案为:Ar;
,元素⑩为Br元素,名称是溴,处于周期表中第第周期第VIIA族,故答案为:Ar; ;溴;第四周期第ⅦA族;
;溴;第四周期第ⅦA族;
(2)上述元素后者Cl非金属性最强,其最高价含氧酸HClO4的酸性越强;上述元素中,K的金属性最强,故KOH的碱性最强,KOH的电子式为 ,
,
故答案为:HClO4; ;
;
(3)④与⑥形成的化合物为Na2S,由钠离子与硫离子构成,形成的是离子化合物,用Na原子、S原子电子式表示其形成过程为: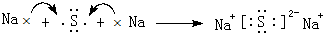 ,故答案为:
,故答案为: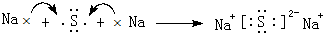 ;离子;
;离子;
(4)四氯化碳为共价化合物,所有原子均满足最外层8个电子的稳定结构,电子式为 ,C与Cl形成的是极性共价键,
,C与Cl形成的是极性共价键,
故答案为: ;极性共价键;
;极性共价键;
(5))③、⑥、⑦三种元素形成的离子分别是:O2-、S2-、Cl-,氧离子电子层数为2,后两者为3层,由于S的原子序数小于Cl,故离子半径:S2->Cl->O2-,
故答案为:S2->Cl->O2-;
(6)钠与氧形成的含有非极性共价键的离子化合物是过氧化钠,过氧化钠是离子化合物,2个O原子形成过氧根离子,电子式为: ,
,
故答案为: ;
;
(7)氨气中N与H形成共价键,电子式为: ,氨气与硝酸反应生成硝酸铵,化学反应方程式为:NH3+HNO3═NH4NO3,故答案为:
,氨气与硝酸反应生成硝酸铵,化学反应方程式为:NH3+HNO3═NH4NO3,故答案为: ;NH3+HNO3═NH4NO3.
;NH3+HNO3═NH4NO3.
点评 本题考查元素周期表与元素周期律,难度不大,注意掌握电子式表示化学键或物质的形成,掌握氢键对物质结构与性质的影响.

 则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )
则1mol阿斯匹林跟足量氢氧化钠溶液充分反应,消耗氢氧化钠的物质的量为( )| A. | 1mol | B. | 2mol | C. | 3mol | D. | 4mol |
| A. | 18和12 | B. | 6和8 | C. | 11和16 | D. | 12和9 |
| A. | 氯气 | B. | 二氧化硫 | C. | 氨气 | D. | 氮气 |
| A. | 溴和汞的气化 | B. | 二氧化硅和C60的熔化 | ||
| C. | 氯化氢和氯化钠的溶解 | D. | 碘和干冰的升华 |
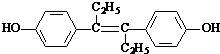
| A. | 它易溶于有机溶剂 | |
| B. | 可与NaOH和Na2CO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,一定有14个碳原子共平面 |
| A. | 用酒精提取碘水中的碘 | |
| B. | 重结晶法除去硝酸钾中的氯化钠 | |
| C. | 蒸馏法分离乙醇和苯酚 | |
| D. | 除去乙烷中少量的乙烯,方法是在光照条件下通氯气 |

 ;
; .
. ,反应类型取代反应.
,反应类型取代反应.