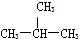
题目内容
18.下列气体无色无味的是( )| A. | 氯气 | B. | 二氧化硫 | C. | 氨气 | D. | 氮气 |
分析 氮气是无色无味的气体,据此解题.
解答 解:A.氯气是黄绿色有刺激性气味的气体,故A错误;
B.二氧化硫是无色有刺激性气味的气体,能溶于水生成亚硫酸,故B错误;
C.氨气是无色有刺激性气味的气体,极易溶于水,故C错误;
D.氮气是无色无味的气体,故D正确.
故选D.
点评 本题考查了气体的物理性质,难度不大,根据气体的颜色和气味来分析解答即可,要注重基础知识的积累.

练习册系列答案
 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
8.某有机物中有一个C6H5-,一个-CH2-,一个-C6H4-,一个-OH,则该有机物中能使FeCl3溶液显紫色结构有( )
| A. | 三种 | B. | 四种 | C. | 五种 | D. | 六种 |
9.下列反应的有机产物中,一定不存在同分异构体的反应是( )
| A. | 1,3-丁二烯(CH2=CH-CH=CH2)与等物质的量的Br2发生加成反应 | |
| B. | 2-氯丁烷( )与NaOH乙醇溶液共热发生消去HCl分子的反应 )与NaOH乙醇溶液共热发生消去HCl分子的反应 | |
| C. | 甲苯在一定条件下与足量硝酸发生硝化反应 | |
| D. | 乙醇与HBr发生的取代反应 |
6.向含有1mol配合物[Co(NH3)5Cl]Cl2的溶液中加入足量的硝酸银溶液,得到的沉淀物质的量为( )
| A. | 1mol | B. | 1.5mol | C. | 2mol | D. | 3mol |
3.下表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同),原子结构示意图为 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是 .
.
(3)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(4)表示①与⑦的化合物的电子式 ,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)④和③形成含有非极性共价键的离子化合物的电子式
(7)元素②的氢化物的结构式为 ;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.
.元素⑩名称为溴在周期表中的位置第四周期第ⅦA族.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是
 .
.(3)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.
,该化合物是由极性共价键(填“极性”、“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-.
(6)④和③形成含有非极性共价键的离子化合物的电子式

(7)元素②的氢化物的结构式为
 ;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
;该氢化物常温下和元素②的最高价氧化物对应水化物反应的化学方程式为NH3+HNO3═NH4NO3.
7.以下是几种常见的制气装置,其中可用于制取乙炔的是( )
| A. |  | B. |  | C. |  | D. |  |
8.下列反应原理中,不符合工业冶炼金属实际情况的是( )
| A. | 2HgO $\frac{\underline{\;\;△\;\;}}{\;}$2Hg+O2↑ | B. | 2A12O3 $\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑ | ||
| C. | H2+Na2O $\frac{\underline{\;高温\;}}{\;}$2Na+H2O | D. | 4 CO+Fe3O4$\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 |

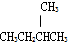 D、
D、 和
和 E、CH3CH2CH2CH3和
E、CH3CH2CH2CH3和