题目内容
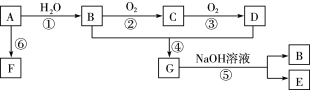
【题目】已知反应aA(g)+bB(g)![]() cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在2L密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
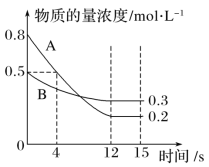
(1)从反应开始到12s时,用A表示的反应速率为___。
(2)经测定,前4s内v(C)=0.05mol·L-1·s-1,则该反应的化学方程式为___。
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测量三个容器中的反应速率分别为甲:v(A)=0.3mol·L-1·s-1,乙:v(B)=0.12mol·L-1·s-1,丙:v(C)=9.6mol·L-1·min-1。则甲、乙、丙三个容器中反应速率由快到慢的顺序为___。
【答案】0.05mol·L-1·s-1 3A(g)+B(g)![]() 2C(g) 乙>甲>丙
2C(g) 乙>甲>丙
【解析】
要书写反应的化学方程式,在已知反应物和生成物的前提下,需求出各物质的化学反应速率,利用反应速率之比等于化学计量数之比,求出各物质的化学计量数的最简整数比,再据计算结果,即可得出各物质的化学计量数。
(1)从反应开始到12s时,用A表示的反应速率为![]() =0.05mol·L-1·s-1;
=0.05mol·L-1·s-1;
(2)经测定,前4s内v(C)=0.05mol·L-1·s-1,v(A)=![]() =0.075mol·L-1·s-1,v(A): v(C)= 0.075mol·L-1·s-1: 0.05mol·L-1·s-1=3:2,12s时,c(A)=0.6mol/L,c(B)=0.2mol/L,则a:b=0.6:0.2=3:1,从而得出a:b:c=3:1:2;因为12s之后,各物质的浓度都大于0,所以该反应为可逆反应;故该反应的化学方程式为3A(g)+B(g)
=0.075mol·L-1·s-1,v(A): v(C)= 0.075mol·L-1·s-1: 0.05mol·L-1·s-1=3:2,12s时,c(A)=0.6mol/L,c(B)=0.2mol/L,则a:b=0.6:0.2=3:1,从而得出a:b:c=3:1:2;因为12s之后,各物质的浓度都大于0,所以该反应为可逆反应;故该反应的化学方程式为3A(g)+B(g)![]() 2C(g);
2C(g);
(3)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测量三个容器中的反应速率分别为
甲:v(A)=0.3mol·L-1·s-1,
乙:v(B)=0.12mol·L-1·s-1,则v(A)=0.36mol·L-1·s-1,
丙:v(C)=9.6mol·L-1·min-1,则v(A)=0.24mol·L-1·s-1,
则甲、乙、丙三个容器中反应速率由快到慢的顺序为乙>甲>丙。

 阶梯计算系列答案
阶梯计算系列答案【题目】在钢铁工业中,锰的用量仅次于铁.锰的冶炼所用原料为锰矿石,主要含菱锰矿![]() ,另常含有
,另常含有![]() 、FeO、
、FeO、![]() 、NaCl和石灰等.
、NaCl和石灰等.
金属阳离子 |
|
|
|
|
|
开始至沉淀 完全的pH |
|
|
|
|
|
请回答下列问题:
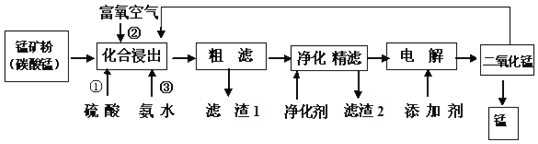
![]() 在化合浸出中,为了提高浸出率提高产品纯度,通常采用______
在化合浸出中,为了提高浸出率提高产品纯度,通常采用______![]() 至少写两种方法
至少写两种方法![]()
![]() 在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为
在该工艺流程中滤渣1成分化学式为______;通常加入净化剂主要成分为![]() ,滤渣2化学式为______.
,滤渣2化学式为______.
![]() 打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
打捞韩国“岁月号”沉船是水下作业,潜水员需要呼吸的就是富氧空气.流程中用富氧空气作氧化剂,降低生产成本.流程中用的空气是用膜分离法制备的富氧空气,该方法的原理是______
![]() 写出电解操作时阳极的电极反应式______.
写出电解操作时阳极的电极反应式______.
![]() 铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
铝热法产生的废渣含有二氧化锰,可以作为氧化剂加入化合浸出,提高锰矿的利用率,则离子反应方程式是:______.
![]() 在电解液中
在电解液中![]() 不宜过大,否则在电解过程中会产生污染物,通常要定时检测
不宜过大,否则在电解过程中会产生污染物,通常要定时检测![]() 的大小,资料显示
的大小,资料显示![]() ,
,![]() ,且
,且![]() 为砖红色,通常采用
为砖红色,通常采用![]() 为滴定剂,用
为滴定剂,用![]() 作指示剂进行定量测定
作指示剂进行定量测定![]() 的大小.请描述该沉淀滴定终点时的现象:______;当
的大小.请描述该沉淀滴定终点时的现象:______;当![]() 沉淀完全时
沉淀完全时![]() 开始沉淀,此时溶液中
开始沉淀,此时溶液中![]() ______.
______.