题目内容
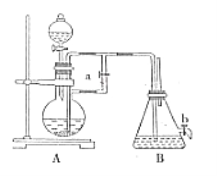
【题目】铁、铝的混合物进行如下实验:

(1)操作X的名称是________________;
(2)气体A是___________(填化学式);
(3)溶液B中阴离子除OH- 外还有__________(填离子符号),溶液D中存在的金属离子为_________(填离子符号);
(4)加入足量NaOH溶液时发生反应的离子方程式为:_________;加入稀盐酸发生反应的离子方程式为:___________________________________________;
(5)向溶液D加入NaOH溶液,观察到产生的白色絮状沉淀迅速变为灰绿色,最终变为红褐色,请写出沉淀转化的化学方程式:___________。
【答案】过滤 H2 AlO2- Fe2+ 2Al+2OH-+2H2O=2AlO2-+3H2↑ Fe+2H+=Fe2++H2↑ 4 Fe(OH)2+O2+2H2O=4Fe(OH)3
【解析】
根据题干给出的实验步骤及铝和铁及其化合物的性质分析解答。
金属铁和金属铝的混合物中加入氢氧化钠后,会和金属铝发生反应生成偏铝酸钠和氢气,金属铁和氢氧化钠不反应,所以A是氢气,B是偏铝酸钠和过量的氢氧化钠的混合物,固体C是金属铁,金属铁可以和盐酸反应生成氯化亚铁和氢气,所以D是氯化亚铁。
(1)实现金属铁和偏铝酸钠、氢氧化钠混合物分离的方法是过滤,故答案为:过滤;
(2)气体A是氢气,故答案为:H2;
(3)溶液B是偏铝酸钠和过量的氢氧化钠的混合物,铁可以和盐酸反应生成氯化亚铁和氢气,D是氯化亚铁,故答案为:AlO2-;Fe2+;
(4)根据离子方程式的书写规则得:2Al+2OH-+2H2O=2AlO2-+3H2↑;Fe+2H+=Fe2++H2↑
(5)颜色的变化是白色的氢氧化亚铁沉淀被氧化成红褐色的氢氧化铁,方程式为:4 Fe(OH)2+O2+2H2O=4Fe(OH)3。