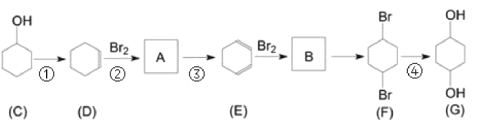
题目内容
【题目】K2Cr2O7是一种强氧化剂,在酸性条件下与乙醇发生如下反应: 3CH3CH2OH+2K2Cr2O7+8H2SO4=2Cr2(SO4)3+3CH3COOH+2K2SO4+11H2O
(1)Cr基态核外电子排布式为________。
(2)K、S、O三种元素的第一电离能由大到小的顺序为________。
(3)乙醇的沸点比甲醚(CH3OCH3)的高,主要原因是________。与H2O空间结构相同的一种阴离子为________(填化学式)。
(4)[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为________。
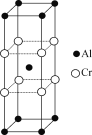
(5)某铬铝合金是一种轻质高温材料,其晶胞结构如图所示,该晶体中n(Cr)∶n(Al)=________。
【答案】1s22s22p63s23p63d54s1或[Ar]3d54s1 O>S>K 乙醇分子间存在氢键 NH2- 16×6.02×1023个或16NA 1∶1
【解析】
(1)Cr是24号元素,根据构造原理及原子核外电子处于全满、半满或全空时是稳定结构分析;
(2)元素的金属性越强,其第一电离能越小;元素的非金属性越强,其第一电离能越大分析;
(3)根据乙醇属于分子晶体,分子之间存在氢键分析判断;结合等电子体结构相似,性质相似分析;
(4)在该离子中含有两种配位体,配位体与中心离子之间通过配位键结合,再分析H2O中含有的共价键进行计算;
(5)用均摊法计算一个晶胞中含有的Cr、Al数目,然后计算二者的物质的量的比。
(1)Cr是24号元素,根据构造原理及原子核外电子排布规律可知基态核外电子排布式为1s22s22p63s23p63d54s1或写为[Ar]3d54s1;
(2)K是金属元素,O、S是非金属元素,元素的非金属性O>S>K,由于元素的金属性越强,其第一电离能越小;元素的非金属性越强,其第一电离能越大,所以这三种元素的第一电离能由大到小的顺序为O>S>K;
(3)乙醇和甲醚都是由分子通过分子间作用力构成的分子晶体,由于乙醇分子之间除存在分子间作用力外,还存在氢键,增加了分子之间的相互吸引力,使乙醇的沸点比其同分异构体甲醚(CH3OCH3)的高;H2O是V形分子,由于等电子体结构相似,性质也相似,则与H2O空间结构相同的一种阴离子为NH2-;
(4)络离子[Cr(H2O)5Cl]Cl2·H2O是铬(Ⅲ)的一种配合物,在1个[Cr(H2O)5Cl]2+中,中心离子Cr3+与5个H2O、1个Cl-通过6个配位键结合,配位键都是共价单键,属于σ键;在1和H2O中含有2个C-H共价键,属于σ键,所以1 个 [Cr(H2O)5Cl]2+中含有σ键的数目为6+5×2=16个,则在1 mol [Cr(H2O)5Cl]2+中含有σ键的数目为16NA;
(5)根据晶胞结构可知Al原子在晶胞8个顶点上和晶胞体内,因此含有的Al原子数目为1+![]() ×8=2;Cr原子有8个,位于晶胞的棱边上,则含有的Cr原子数目为:
×8=2;Cr原子有8个,位于晶胞的棱边上,则含有的Cr原子数目为:![]() ×8=2,所以该晶体中n(Cr)∶n(Al)=2:2=1:1。
×8=2,所以该晶体中n(Cr)∶n(Al)=2:2=1:1。