题目内容
8.根据所给下列4组物质,填写下表空白:A.CuO、CO2、SO2、H2O B. Cl2、Na、Fe、Cu
C.HCl、HNO3、H2SO4、H2O D.Na2CO3、KCl、NaOH、AgNO3
| A组 | B组 | C组 | D组 | |
| 分类标准 | 非金属氧化物 | 金属单质 | 酸 | 盐 |
| 不属于该类别的物质 | CuO | Cl2 | H2O | NaOH |
分析 A、CuO属于金属氧化物;CO2、SO2、H2O属于非金属氧化物;
B、Cl2是非金属单质,Na、Fe、Cu属于金属单质;
C、HCl、HNO3、H2SO4属于酸类,H2O属于氧化物;
D、Na2CO3、KCl、AgNO3属于盐类,NaOH属于碱类.
解答 解:CuO属于金属氧化物;CO2、SO2、H2O属于非金属氧化物,符合要求的物质是CuO;
Cl2是非金属单质,Na、Fe、Cu属于金属单质,符合要求的物质是Cl2;
HCl、HNO3、H2SO4属于酸类,H2O属于氧化物,符合要求的物质是H2O;
Na2CO3、KCl、AgNO3属于盐类,NaOH属于碱类,符合要求的物质是NaOH.
故答案为:CuO;金属单质;H2O;盐.
点评 本题考查了物质分类的方法和物质组成的判断应用,掌握概念是解题关键,题目较简单.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
12.由K2SO4、Al2(SO4)?3、H2SO4及KAl(SO4)?2•12H2O组成的混合溶液,测得c(H+)?=0.3mol•L-1,c(Al3+)=0.3mol•L-1,c(SO42-)?=0.8mol•L-1,则c(K+)为( )
| A. | 0.15mol/L | B. | 0.2mol/L | C. | 0.3mol/L | D. | 0.4mol/L |
20.下列有关实验的操作、原理和现象,正确的是( )
| A. | 取一定量酸性高锰酸钾溶液和过量草酸(H2C2O4)溶液混合,分成三等份,分别置于不同的温度下,观察比较溶液颜色变化的快慢以探究温度对反应速率的影响 | |
| B. | 可用酒精萃取溴水,将分液漏斗振摇几次后需要从分液漏斗上口放气 | |
| C. | 标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低 | |
| D. | 用镊子夹取金属钠固体,切割取用后剩余的钠不能放回原试剂瓶中 |
17.已知下列三个反应:2Fe3++2I-═2Fe2++I2;2Fe2++Cl2═2Fe3++2Cl-;2MnO4-+10Cl-+16H+═2Mn2++5Cl2↑+8H2O,某溶液中有Fe2+、Cl-和I-,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )
| A. | Cl2 | B. | KMnO4 | C. | 浓HCl | D. | FeCl3 |
18.(1)下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的电子式是: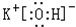 .
.
(2)在盛有500mL 0.1mol/LCuSO4溶液的大烧杯中.用锌、铜作电极,用导线连接形成原电池,写出电极反应式:负极Zn-2e-=Zn2+; 正极Cu2++2e-=Cu.
(3)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是B
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在盛有500mL 0.1mol/LCuSO4溶液的大烧杯中.用锌、铜作电极,用导线连接形成原电池,写出电极反应式:负极Zn-2e-=Zn2+; 正极Cu2++2e-=Cu.
(3)过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是B
A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸.

 .
.
 .
. 连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体