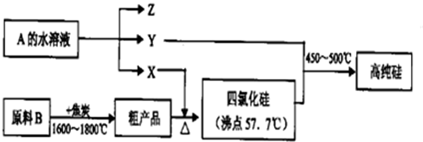
题目内容
19.某企业排放的含铬废水中含有较多毒性较大的Cr2O72-,该研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程: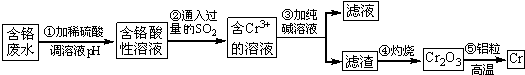
(1)第②步反应的离子方程式是Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O.
(2)第③步反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式是CO2.
(3)第④步灼烧所需的仪器除三脚架、坩埚钳、坩埚、玻璃棒外,还需要酒精灯、泥三角.
(4)若该含铬废水中含6.00×10-3mol•L-1 Cr2O72-,欲使500mL该废水中的 Cr2O72-完全转化为金属铬,理论上需要加入0.162g铝粒.
分析 Cr2O72-有较强氧化性,二氧化硫具有还原性,在酸性介质中发生氧化还原反应,二氧化硫将Cr2O72-还原成Cr3+,由实验流程可知,加Na2CO3时,产生Cr(OH)3沉淀,Cr(OH)3灼烧得到Cr2O3,用铝在高温条件下还原Cr2O3得Cr,结合元素守恒和电子守恒进行答题.
解答 解:Cr2O72-有较强氧化性,二氧化硫具有还原性,在酸性介质中发生氧化还原反应,二氧化硫将Cr2O72-还原成Cr3+,由实验流程可知,加Na2CO3时,产生Cr(OH)3沉淀,Cr(OH)3灼烧得到Cr2O3,用铝在高温条件下还原Cr2O3得Cr,
(1)Cr2O72-具有强氧化性,能将二氧化硫中+4价的硫氧化为+6价,离子反应为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O,
故答案为:Cr2O72-+2H++3SO2═2Cr3++3SO42-+H2O;
(2)第③步反应为Cr3+与碳酸根离子双水解得Cr(OH)3沉淀外,还会产生某种气体,根据元素守恒要知该气体为CO2,
故答案为:CO2;
(3)灼烧固体物质所需的仪器除三脚架、坩埚钳、坩埚、玻璃棒外,还需要酒精灯、泥三角,
故答案为:酒精灯、泥三角;
(4)含铬废水中含6.00×10-3mol•L-1 Cr2O72-,所以500mL该废水中的 Cr2O72-的物质的量为3.00×10-3mol,得到Cr2O3的物质的量为3.00×10-3mol,铝在高温条件下还原Cr2O3得Cr,有关系式Cr2O3~2Al,所以理论上需要加入铝的质量为6.00×10-3×27g=0.162g,
故答案为:0.162.
点评 本题以工业废水处理为载体,考查氧化还原反应、离子反应、关系式计算等,难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.

| A. | 一定温度下,pH=6的纯水中含有OH-的数目为10-6NA | |
| B. | 120g NaHSO4固体中含有的离子总数为2NA | |
| C. | 标准状况下,22.4L乙烷中所含分子的数目为NA | |
| D. | 100mL 0.5mol/L-1的(NH4)2SO4溶液中,NH4+的数目为0.1NA |
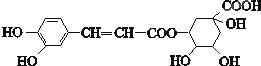
| A. | 分子式为C16H18O9 | |
| B. | 0.1mol绿原酸最多与含0.4molNaOH溶液反应 | |
| C. | 能发生取代、还原、氧化和消去反应 | |
| D. | 0.1mol绿原酸最多与含0.6molBr2的浓溴水反应 |
| 化学反应 | 平衡常温 | 温度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O(g)+CO(g) | K2 | 1.0 | 2.5 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O(g) | K3 | ||
(2)某温度下反应①中H2的平衡转化率(a)与体系总压强(p)的关系如图甲所示.则平衡状态由A变到B时,平衡常数K(A)=K(B)(填“>”“<”或“=”).
(3)据反应①与②可推导出K1、K2与K3之间的关系,则K3=K1•K2(用K1、K2表示).500℃时测得反应③在某时刻时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol•L-1)分别为0.8、0.1、0.3、0.15,则此时v正>v逆(填“>”“=”或“<”).
(4)在3L容积可变的密闭容器中发生反应②,已知c(CO)-t(反应时间)变化曲线Ⅰ如图乙所示,若在t0时刻分别改变一个条件,曲线Ⅰ变为曲线Ⅱ和曲线Ⅲ
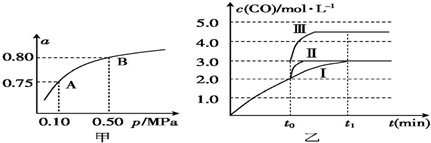
当曲线Ⅰ变为曲线Ⅱ时,改变的条件是加入催化剂
当曲线Ⅰ变为曲线Ⅲ时,改变的条是将容器的体积快速压缩至2L.
A.CuO、CO2、SO2、H2O B. Cl2、Na、Fe、Cu
C.HCl、HNO3、H2SO4、H2O D.Na2CO3、KCl、NaOH、AgNO3
| A组 | B组 | C组 | D组 | |
| 分类标准 | 非金属氧化物 | 金属单质 | 酸 | 盐 |
| 不属于该类别的物质 | CuO | Cl2 | H2O | NaOH |
| A. | 生成 SO3 为2mol | |
| B. | 单位时间消耗amol O2,同时消耗2amol SO2 | |
| C. | SO2 和 SO3物质的量之和一定为 2mol | |
| D. | SO2和SO3的浓度一定相等 |