题目内容
【题目】向一定量下列物质的溶液中逐滴加入氢氧化钠溶液,先生成白色沉淀,后沉淀逐渐溶解,这种物质是( )
A.硫酸镁B.四羟基合铝酸钠C.氯化铝D.氯化铁
【答案】C
【解析】
A、MgSO4和NaOH反应产生的Mg(OH)2白色沉淀不溶于NaOH溶液,A错误;
B、四羟基合铝酸钠不和NaOH溶液反应,不会产生白色沉淀,B错误;
C、AlCl3和NaOH反应产生的Al(OH)3白色沉淀能溶于NaOH溶液,C正确;
D、FeCl3和NaOH反应产生的Fe(OH)3呈红棕色,且该沉淀不溶于NaOH溶液,D错误;
故选C。

【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 原子核电荷数是内层电子数的4倍 |
C | 1molC单质能与冷水反应,在标准状况下生成11.2L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是__________;
(3)C和D简单离子的半径大小为____ >_____;(用离子符号表示)
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 _____________________________ 。
(5)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中可行的是_________(填序号);
a.比较两种单质的颜色 b. 依据两元素在周期表中的位置
c.比较氢化物的稳定性 d.依据两元素单质在自然界中的存在状态
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
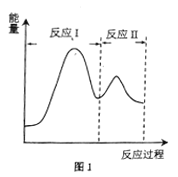
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。

【题目】下表是元素周期表的一部分,请回答有关问题:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为____________。
(2)⑨在元素周期表中的位置是________________________。
(3)用电子式表示④元素与⑦元素形成化合物的过程________________________。
(4)可以用来验证④⑤两元素金属性强弱的实验是_______________________。(填字母代号)
(a)将在空气中放置已久的这两种元素的块状单质分别放入水中
(b)将形状、大小相同的这两种元素的单质分别和同浓度的盐酸反应
(c)将形状、大小相同两种元素的单质分别和热水作用,并滴入酚酞
(d)均比较这两种元素的气态氢化物的稳定性
(5)⑥和⑦阴离子还原性较强的是(填微粒符号):____________用一个置换反应证实这一结论(写化学方程式)____________________________________。
【题目】硫酸锌被广泛应用于医药领域和工农业生产。工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO47H2O的一种流程如图:

(1)步骤Ⅰ的操作是____________。
(2)步骤Ⅰ加入稀硫酸进行酸浸时,需不断通入高温水蒸气的目的是______________。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为____________________________________________。
(4)步骤Ⅲ中,加入锌粉的作用是______________。
(5)已知硫酸锌的溶解度与温度之间的关系如下表:
温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度/g | 41.8 | 54.1 | 70.4 | 74.8 | 67.2 | 60.5 |
从硫酸锌溶液中获得硫酸锌晶体的实验操作为________________、冷却结晶、过滤。烘干操作需在减压低温条件下进行,原因是_________________________________。
(6)取28.70 g ZnSO47H2O加热至不同温度,剩余固体的质量变化如图所示。分析数据,680℃时所得固体的化学式为______。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4H2O


