题目内容
【题目】短周期元素A、B、C、D、E的原子序数依次增大,其元素特征信息如下表:
元素编号 | 元素特征信息 |
A | 最高正价和最低负价的绝对值之差为2 |
B | 原子核电荷数是内层电子数的4倍 |
C | 1molC单质能与冷水反应,在标准状况下生成11.2L H2 |
D | 原子最外层电子数等于其周期序数 |
E | 负二价阴离子的电子层结构与Ar原子相同 |
(1)E的简单离子的结构示意图为____________;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是__________;
(3)C和D简单离子的半径大小为____ >_____;(用离子符号表示)
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,写出产生该现象的化学方程式 _____________________________ 。
(5)元素非金属性强弱比较有很多方法,其中B和E的非金属性强弱的研究方案中可行的是_________(填序号);
a.比较两种单质的颜色 b. 依据两元素在周期表中的位置
c.比较氢化物的稳定性 d.依据两元素单质在自然界中的存在状态
【答案】![]() Na3N Na+ Al3+ NH3+HNO3 = NH4NO3 b c
Na3N Na+ Al3+ NH3+HNO3 = NH4NO3 b c
【解析】
短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为ⅤA族元素,结合原子序数大小可知A为N元素;
B原子核电荷数是内层电子数的4倍,结合原子序数大小可知B为O元素;
1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为:![]() =0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;
=0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;
D的原子最外层电子数等于其周期序数,D的原子序数大于Na,则D为第三周期第ⅢA族元素,为Al元素;
E的负二价阴离子的电子层结构与Ar原子相同,其质子数为18-2=16,所以E为S元素,然后结合元素周期律的知识进行解答。
短周期元素A、B、C、D、E的原子序数依次增大,A的最高正价和最低负价的绝对值之差为2,则A的最高正价为+5,负价为-3,所以A为ⅤA族元素,结合原子序数大小可知A为N元素;
B原子核电荷数是内层电子数的4倍,结合原子序数大小可知B为O元素;
1molC单质能与冷水反应,在标准状况下生成11.2LH2,氢气的物质的量为:![]() =0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;
=0.5mol,则1molC完全反应失去1mol电子,则C为Na元素;
D的原子最外层电子数等于其周期序数,D的原子序数大于Na,则D为第三周期第ⅢA族元素,为Al元素;
E的负二价阴离子的电子层结构与Ar原子相同,其质子数为18-2=16,所以E为S元素。
(1)E为S元素,其简单离子S2-的结构示意图为![]() ;
;
(2)C元素和A元素能化合形成C3A的化合物,该化合物化学式是Na3N;
(3)具有相同电子层结构的离子,核电荷数越大半径越小,故C和D简单离子的半径大小为Na+ > Al3+;
(4)用两根玻璃棒分别蘸取A元素最高价氧化物对应水化物的浓溶液和A元素的氢化物的浓溶液,相互接近时,可看到大量的白烟,生成硝酸铵,产生该现象的化学方程式为NH3+HNO3 = NH4NO3;
(5)a.不能利用物理性质(如颜色、状态)来比较非金属性,可利用氢化物的稳定性或元素在周期表中的位置等来比较非金属性,故答案选b c。

 阅读快车系列答案
阅读快车系列答案【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:
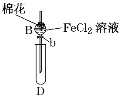
Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |


