ΧβΡΩΡΎ»ί
ΓΨΧβΡΩΓΩœ¬±μ «‘ΣΥΊ÷ήΤΎ±μΒΡ“Μ≤ΩΖ÷Θ§«κΜΊ¥π”–ΙΊΈ ΧβΘΚ
÷ςΉε÷ήΤΎ | ΔώA | ΔρA | ΔσA | ΔτA | ΔθA | ΔωA | ΔςA | 0 |
2 | ΔΌ | ΔΎ | Δέ | |||||
3 | Δή | Δί | Δό | ΔΏ | Δύ | |||
4 | Δα | Δβ |
(1)±μ÷–Μ·―ß–‘÷ Ήν≤ΜΜνΤΟΒΡ‘ΣΥΊΘ§Τδ‘≠Ή”ΫαΙΙ Ψ“βΆΦΈΣ____________ΓΘ
(2)Δα‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΒΡΈΜ÷Ο «________________________ΓΘ
(3)”ΟΒγΉ” Ϋ±μ ΨΔή‘ΣΥΊ”κΔΏ‘ΣΥΊ–Έ≥…Μ·ΚœΈοΒΡΙΐ≥Χ________________________ΓΘ
(4)Ω…“‘”Οά¥―ι÷ΛΔήΔίΝΫ‘ΣΥΊΫπ τ–‘«Ω»θΒΡ Β―ι «_______________________ΓΘ(ΧνΉ÷ΡΗ¥ζΚ≈)
(a)ΫΪ‘ΎΩ’Τχ÷–Ζ≈÷Ο“―ΨΟΒΡ’βΝΫ÷÷‘ΣΥΊΒΡΩιΉ¥ΒΞ÷ Ζ÷±πΖ≈»κΥ°÷–
(b)ΫΪ–ΈΉ¥ΓΔ¥σ–ΓœύΆ§ΒΡ’βΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ Ζ÷±πΚΆΆ§≈®Ε»ΒΡ―ΈΥαΖ¥”Π
(c)ΫΪ–ΈΉ¥ΓΔ¥σ–ΓœύΆ§ΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ Ζ÷±πΚΆ»»Υ°Ής”ΟΘ§≤ΔΒΈ»κΖ”ΧΣ
(d)Ψυ±»Ϋœ’βΝΫ÷÷‘ΣΥΊΒΡΤχΧ§«βΜ·ΈοΒΡΈ»Ε®–‘
(5)ΔόΚΆΔΏ“θάκΉ”ΜΙ‘≠–‘Ϋœ«ΩΒΡ «(ΧνΈΔΝΘΖϊΚ≈)ΘΚ____________”Ο“ΜΗω÷ΟΜΜΖ¥”Π÷Λ Β’β“ΜΫα¬έ(–¥Μ·―ßΖΫ≥Χ Ϋ)____________________________________ΓΘ
ΓΨ¥πΑΗΓΩ ΒΎΥΡ÷ήΤΎΒΎIAΉε
ΒΎΥΡ÷ήΤΎΒΎIAΉε ![]() bc S2- Cl2+Na2S=2NaCl+SΓΐ
bc S2- Cl2+Na2S=2NaCl+SΓΐ
ΓΨΫβΈωΓΩ
ΗυΨί‘ΣΥΊ÷ήΤΎ±μΖ÷±πΆΤΕœ≥ωΔΌΓΪΔβΒΡ‘ΣΥΊΖ÷±πΈΣCΓΔNΓΔFΓΔMgΓΔAlΓΔSΓΔClΓΔArΓΔKΓΔBrΘ§
Θ®1Θ©œΓ”–ΤχΧεΒΡ–‘÷ Ήν≤ΜΜνΤΟΘΜ
Θ®2Θ©KΒΡ‘≠Ή”ΫαΙΙ÷–”–4ΗωΒγΉ”≤ψΓΔΉνΆβ≤ψΒγΉ” ΐΈΣ1ΘΜ
Θ®3Θ©Δή”κΔΏ–Έ≥…ΒΡΜ·ΚœΈοΈΣ¬»Μ·ΟΨΘ§ΈΣάκΉ”Μ·ΚœΈοΘΜ
Θ®4Θ©”…Ϋπ τ”κΥαΜρΥ°ΒΡΖ¥”ΠΓΔΕ‘”ΠΦνΒΡΦν–‘ΓΔΫπ τΒΞ÷ ÷°ΦδΒΡ÷ΟΜΜΖ¥”ΠΒ»±»ΫœΫπ τ–‘ΘΜ
Θ®5Θ©Ζ«Ϋπ τ–‘‘Ϋ«ΩΘ§Ε‘”Π“θάκΉ”ΒΡΜΙ‘≠–‘‘Ϋ»θΘ§Ω…”…Ζ«Ϋπ τΒΞ÷ ÷°ΦδΒΡ÷ΟΜΜΖ¥”ΠΥΒΟςΓΘ
”…‘ΣΥΊ‘Ύ÷ήΤΎ±μΒΡΈΜ÷ΟΩ…÷ΣΘ§ΔΌΓΪΔβΖ÷±πΈΣCΓΔNΓΔFΓΔMgΓΔAlΓΔSΓΔClΓΔArΓΔKΓΔBrΘ§
Θ®1Θ©±μ÷–Μ·―ß–‘÷ Ήν≤ΜΜνΤΟΒΡ‘ΣΥΊΈΣArΘ§Τδ‘≠Ή”ΫαΙΙ Ψ“βΆΦΈΣ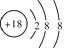 Θ§Ι ¥πΑΗΈΣΘΚ
Θ§Ι ¥πΑΗΈΣΘΚ ΘΜ
ΘΜ
Θ®2Θ©ΔαΚ≈‘ΣΥΊ «KΘ§‘Ύ‘ΣΥΊ÷ήΤΎ±μ÷–ΒΡΈΜ÷Ο «ΒΎΥΡ÷ήΤΎΒΎΔώAΉεΘ§Ι ¥πΑΗΈΣΘΚΒΎΥΡ÷ήΤΎΒΎΔώAΉεΘΜ
Θ®3Θ©Δή”κΔΏ–Έ≥…ΒΡΜ·ΚœΈοΈΣ¬»Μ·ΟΨΘ§¬»Μ·ΟΨΈΣάκΉ”Μ·ΚœΈοΘ§”…άκΉ”–Έ≥…άκΉ”ΦϋΘ§Τδ–Έ≥…Ιΐ≥ΧΈΣ![]() ΘΜ
ΘΜ
Ι ¥πΑΗΈΣΘΚ![]() ΘΜ
ΘΜ
Θ®4Θ©aΘ°ΫΪ‘ΎΩ’Τχ÷–Ζ≈÷Ο“―ΨΟΒΡ’βΝΫ÷÷‘ΣΥΊΒΡΩιΉ¥ΒΞ÷ Ζ÷±πΖ≈»κΥ°÷–Θ§Ϋπ τΩ…Ρή±Μ―θΜ·Θ§≤ΜΡή±»ΫœΫπ τ–‘Θ§Ι ≤Μ―ΓΘΜ
bΘ°ΫΪ–ΈΉ¥ΓΔ¥σ–ΓœύΆ§ΒΡ’βΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ Ζ÷±πΚΆΆ§≈®Ε»ΒΡ―ΈΥαΖ¥”ΠΘ§Ζ¥”ΠΨγΝ“ΒΡΕ‘”ΠΫπ τΒΡΫπ τ–‘«ΩΘ§Ι ―ΓΘΜ
cΘ°ΫΪ–ΈΉ¥ΓΔ¥σ–ΓœύΆ§ΒΡ’βΝΫ÷÷‘ΣΥΊΒΡΒΞ÷ Ζ÷±πΚΆΈ¬Ε»œύΆ§ΒΡ»»Υ°Ής”ΟΘ§≤ΔΒΈ»κΖ”ΧΣΘ§Ζ¥”ΠΨγΝ“«“Κλ…Ϊ…νΒΡΥΒΟςΦν–‘«ΩΘ§Ε‘”ΠΫπ τΒΡΫπ τ–‘‘Ϋ«ΩΘ§Ω…±»ΫœΫπ τ–‘Θ§Ι ―ΓΘΜ
dΘ°±»Ϋœ’βΝΫ÷÷‘ΣΥΊΒΡ«βΜ·ΈοΒΡΈ»Ε®–‘Θ§Ω…±»ΫœΖ«Ϋπ τ–‘ΒΡ«Ω»θΘ§Ι ≤Μ―ΓΘΜ
Ι ¥πΑΗΈΣΘΚbcΘΜ
Θ®5Θ©Ζ«Ϋπ τ–‘SΘΦClΘ§‘ρΔόΔΏΝΫ÷÷‘ΣΥΊΒΡΦρΒΞ“θάκΉ”ΜΙ‘≠–‘Ϋœ«ΩΒΡ «S2-Θ§»γNa2S+Cl2ΘΫ2NaCl+SΓΐΩ…ΥΒΟςΘ§Ι ¥πΑΗΈΣΘΚS2-ΘΜNa2S+Cl2ΘΫ2NaCl+SΓΐΓΘ

 ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ
ΧλΧλœρ…œ“Μ±ΨΚΟΨμœΒΝ–¥πΑΗ –Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗ
–Γ―ß…ζ10Ζ÷÷””Π”ΟΧβœΒΝ–¥πΑΗΓΨΧβΡΩΓΩΡ≥Μ·―ßΖ¥”Π÷–Θ§…ηΖ¥”ΠΈοΒΡΉήΡήΝΩΈΣE1Θ§…ζ≥…ΈοΒΡΉήΡήΝΩΈΣE2Θ§
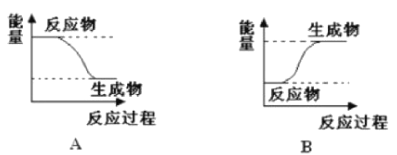
(1)»τE1>E2Θ§‘ρΗΟΖ¥”ΠΈΣ_____________(ΧνΓΑΖ≈»»Γ±ΜρΓΑΈϋ»»Γ±)Ζ¥”ΠΓΘΗΟΖ¥”ΠΩ…”ΟΆΦ_____________(ΧνΓΑAΓ±ΜρΓΑBΓ±)±μ ΨΓΘ
(2)»τE1ΘΦE2Θ§‘ρΗΟΖ¥”ΠΈΣ_____________(ΧνΓΑΖ≈»»Γ±ΜρΓΑΈϋ»»Γ±)Ζ¥”ΠΓΘΗΟΖ¥”ΠΩ…”ΟΆΦ___________(ΧνΓΑAΓ±ΜρΓΑBΓ±)±μ Ψ
(3)ΧΪ―τΡήΒΡΩΣΖΔΚΆάϊ”Ο «21 άΦΆΒΡ“ΜΗω÷Ί“ΣΩΈΧβΓΘ
ΔΌάϊ”Ο¥ΔΡήΫι÷ ¥Δ¥φΧΪ―τΡήΒΡ‘≠άμ «ΑΉΧλ‘ΎΧΪ―τ’’…δœ¬Θ§Ρ≥÷÷―Έ»έΜ·Θ§Έϋ ’»»ΝΩΘΜΆμΦδ»έ―Έ ΆΖ≈≥ωœύ”ΠΡήΝΩΘ§¥”Εχ Ι “Έ¬ΒΟ“‘ΒςΫΎΓΘ“―÷Σœ¬Ν– ΐΨίΘΚ
―Έ | »έΒψ/Γφ | »έΜ·Έϋ»»KJΓΛmol-1 | ≤ΈΩΦΦέΗώ/‘Σ |
CaCl2ΓΛ6H2O | 29.0 | 37.3 | 780850 |
Na2SO4ΓΛl0H2O | 32.4 | 77.0 | 800900 |
Na2HPO4ΓΛ12H2O | 36.1 | 100.1 | 1600-2000 |
Na2S2O3ΓΛ5H2O | 48.5 | 49.7 | 1400-1800 |
Τδ÷–Ήν “ΥΉς¥ΔΡήΫι÷ ΒΡ“Μ÷÷―Έ «_____________(ΧνΉ÷ΡΗ)ΓΘ
A CaCl2ΓΛ6H2O
B Na2SO4ΓΛl0H2O
C Na2HPO4ΓΛ12H2O
D Na2S2O3ΓΛ5H2O
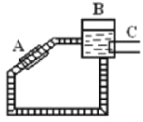
ΔΎΆΦ «“Μ÷÷ΧΪ―τΡή»»Υ°ΤςΒΡ Ψ“βΆΦΘ§ΆΦ÷–A «Φ·»»ΤςΘ§B «¥ΔΥ°»ίΤςΘ§C «Ι©“θΧλ ±Φ”»»ΒΡΗ®÷ζΒγ»»ΤςΓΘΗυΨίΕ‘Υ°ΒΡΟήΕ»ΒΡ»œ ΕΘ§ΡψΙάΦΤ‘Ύ―τΙβ’’…δœ¬Υ°ΫΪ―Ί_________(ΧνΓΑΥ≥Γ±ΜρΓΑΡφΓ±) ±’κΖΫœρΝςΕ·ΓΘ
ΓΨΧβΡΩΓΩΒ®Ζ·![]() «“Μ÷÷÷Ί“ΣΒΡΚ§Ά≠Μ·ΚœΈοΘ§Ρ≥ΩΈΆβ―–ΨΩ–ΓΉι”Ο¥÷Ά≠(Κ§…ΌΝΩ
«“Μ÷÷÷Ί“ΣΒΡΚ§Ά≠Μ·ΚœΈοΘ§Ρ≥ΩΈΆβ―–ΨΩ–ΓΉι”Ο¥÷Ά≠(Κ§…ΌΝΩ![]() )Ά®Ιΐ≤ΜΆ§ΒΡΜ·―ßΖ¥”Π÷Τ»ΓΒ®Ζ·ΒΡΙΐ≥Χ»γΆΦΘΚ
)Ά®Ιΐ≤ΜΆ§ΒΡΜ·―ßΖ¥”Π÷Τ»ΓΒ®Ζ·ΒΡΙΐ≥Χ»γΆΦΘΚ

Έο÷ | Άξ»Ϊ≥ΝΒμ ±ΒΡpH |
Fe(OH)3 | 3.2 |
Fe(OH)2 | 9.6 |
Cu(OH)2 | 6.4 |
Β±»ή“Κ÷–±Μ≥ΝΒμάκΉ”ΒΡΈο÷ ΒΡΝΩ≈®Ε»–Γ”Ύ![]() ±Θ§»œΈΣΗΟάκΉ”≥ΝΒμΆξ»ΪΓΘ
±Θ§»œΈΣΗΟάκΉ”≥ΝΒμΆξ»ΪΓΘ
‘ΜΊ¥πœ¬Ν–Έ ΧβΘΚ
Θ®1Θ©œ¬Ν–Έο÷ ÷–Θ§Ήν ΚœΉςΈΣ ‘ΦΝXΒΡ «________(Χν–ρΚ≈)ΓΘ
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
Θ®2Θ©”…¥÷Ά≠Ά®ΙΐΝΫ÷÷ΆΨΨΕ÷Τ»ΓΒ®Ζ·Θ§”κΆΨΨΕΔρœύ±»Θ§ΆΨΨΕΔώ”–Οςœ‘ΒΡΝΫΗω”≈ΒψΘ§Ζ÷±π «______________ΓΔ____________________ΓΘ
Θ®3Θ© ‘ΦΝYΩ…“‘ «______________________(»ΈΧν“Μ÷÷Έο÷ ΒΡΜ·―ß Ϋ)ΓΘ
Θ®4Θ©»τ»ή“ΚC÷–![]() ΓΔ
ΓΔ![]() ΒΡ≈®Ε»Ζ÷±πΈΣ
ΒΡ≈®Ε»Ζ÷±πΈΣ![]() ΓΔ
ΓΔ![]() Θ§‘ρœρ»ή“ΚC÷–Φ”»κ…ΌΝΩ ‘ΦΝYΒΡΙΐ≥Χ÷–”ΠΩΊ÷Τ»ή“ΚCΒΡpHΖΕΈß‘ΦΈΣ________ΓΘ
Θ§‘ρœρ»ή“ΚC÷–Φ”»κ…ΌΝΩ ‘ΦΝYΒΡΙΐ≥Χ÷–”ΠΩΊ÷Τ»ή“ΚCΒΡpHΖΕΈß‘ΦΈΣ________ΓΘ
Θ®5Θ©«βΜ·―«Ά≠![]() «“Μ÷÷Κλ…ΪΙΧΧεΘ§40ΓΪ50Γφ ±Θ§¬Υ“ΚEΚΆ
«“Μ÷÷Κλ…ΪΙΧΧεΘ§40ΓΪ50Γφ ±Θ§¬Υ“ΚEΚΆ![]() »ή“ΚΜλΚœΖ¥”ΠΩ…ΒΟ«βΜ·―«Ά≠≥ΝΒμΘ§Ά§ ±ΒΟΒΫΝρΥαΚΆΝΉΥαΘ§ΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________________________________Θ§ΗΟΖ¥”ΠΟΩΉΣ“Τ1.5
»ή“ΚΜλΚœΖ¥”ΠΩ…ΒΟ«βΜ·―«Ά≠≥ΝΒμΘ§Ά§ ±ΒΟΒΫΝρΥαΚΆΝΉΥαΘ§ΗΟΖ¥”ΠΒΡάκΉ”ΖΫ≥Χ ΫΈΣ___________________________________Θ§ΗΟΖ¥”ΠΟΩΉΣ“Τ1.5![]() ΗωΒγΉ”Θ§…ζ≥…CuHΒΡΈο÷ ΒΡΝΩΈΣ________molΓΘ
ΗωΒγΉ”Θ§…ζ≥…CuHΒΡΈο÷ ΒΡΝΩΈΣ________molΓΘ
Θ®/span>6Θ©Ρ…ΟΉ―θΜ·―«Ά≠![]() «“Μ÷÷”ΟΆΨΙψΖΚΒΡΙβΒγ≤ΡΝœΘ§ΒγΜ·―ßΖ®Ω…”ΟΆ≠ΑτΚΆ ·ΡΪΉςΒγΦΪΘ§ΒγΫβ¬Υ“ΚEΜώΒΟΡ…ΟΉ―θΜ·―«Ά≠Θ§ΒγΫβΙΐ≥Χ÷–ΈόΤχΧε≤ζ…ζΘ§‘ρΆ≠ΑτΉς________ΦΪΘ§…ζ≥…
«“Μ÷÷”ΟΆΨΙψΖΚΒΡΙβΒγ≤ΡΝœΘ§ΒγΜ·―ßΖ®Ω…”ΟΆ≠ΑτΚΆ ·ΡΪΉςΒγΦΪΘ§ΒγΫβ¬Υ“ΚEΜώΒΟΡ…ΟΉ―θΜ·―«Ά≠Θ§ΒγΫβΙΐ≥Χ÷–ΈόΤχΧε≤ζ…ζΘ§‘ρΆ≠ΑτΉς________ΦΪΘ§…ζ≥…![]() ΒΡΒγΦΪΖ¥”Π ΫΈΣ______________________Θ§ΒγΫβΙΐ≥Χ÷–¬Υ“ΚEΒΡ≈®Ε»____________(ΧνΓΑ‘ω¥σΓ±ΓΑ≤Μ±δΓ±ΜρΓΑΦθ–ΓΓ±)ΓΘ
ΒΡΒγΦΪΖ¥”Π ΫΈΣ______________________Θ§ΒγΫβΙΐ≥Χ÷–¬Υ“ΚEΒΡ≈®Ε»____________(ΧνΓΑ‘ω¥σΓ±ΓΑ≤Μ±δΓ±ΜρΓΑΦθ–ΓΓ±)ΓΘ
Θ®7Θ©ΒΟΒΫ![]() ΨßΧεΘ§““¥Φ¥ζΧφ’τΝσΥ°œ¥Β”ΨßΧεΒΡΡΩΒΡ «______________ΓΘ
ΨßΧεΘ§““¥Φ¥ζΧφ’τΝσΥ°œ¥Β”ΨßΧεΒΡΡΩΒΡ «______________ΓΘ

