题目内容
【题目】Na3OCl是一种良好的离子导体,具有反钙钛矿晶体结构。回答下列问题:
(1)Ca小于Ti的是_______(填标号)。
A.最外层电子数 B.未成对电子数 C.原子半径 D.第三电离能
(2)由O、Cl元素可组成不同的单质和化合物,其中Cl2O2能破坏臭氧层。
① Cl2O2的沸点比H2O2低,原因是___________________________________。
② O3分子中心原子杂化类型为_______;O3是极性分子,理由是___________________。
(3)Na3OCl可由以下两种方法制得:
方法Ⅰ Na2O + NaCl![]() Na3OCl
Na3OCl
方法II 2Na + 2NaOH + 2NaCl![]() 2Na3OCl + H2↑
2Na3OCl + H2↑
① Na2O的电子式为____________。
② 在方法Ⅱ的反应中,形成的化学键有_______(填标号)。
A.金属键 B.离子键 C.配位键 D.极性键 E.非极性键
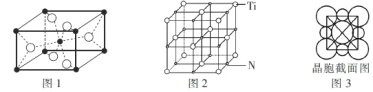
(4)Na3OCl晶体属于立方晶系,其晶胞结构如右所示。已知:晶胞参数为a nm,密度为d g·cm-3。
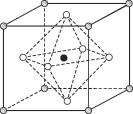
①Na3OCl晶胞中,Cl位于各顶点位置,Na位于_________位置,两个Na之间的最短距离为________nm。
②用a、d表示阿伏加德罗常数的值NA=__________________(列计算式)。
【答案】B H2O2分子间存在氢键 sp2 O3分子为V形结构(或“O3分子中正负电荷重心不重合”等其他合理答案) ![]() BE 面心
BE 面心 ![]()
![]()
【解析】
(1)基态Ca原子核外电子排布为1s22s22p63s23p64s2,基态Ti原子核外电子排布为1s22s22p63s23p63d24s2,结合元素周期律分析判断;
(2)①同种类型晶体的熔沸点高低取决于微粒间作用力的大小,分子间存在氢键的熔沸点高;②根据价层电子对互斥理论和杂化轨道理论分析解答;
(3)Na2O为离子化合物,据此书写其电子式;根据Na3OCl和H2存在的化学键类型判断;
(4)①根据均摊法分析判断Na3OCl晶体结构中空心白球、顶点阴影球、实心黑球的数目再结合Na3OCl化学式分析判断;②由密度公式ρ=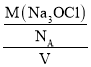 计算解答。
计算解答。
(1)基态Ca原子核外电子排布为1s22s22p63s23p64s2,未成对电子数为0,基态Ti原子核外电子排布为1s22s22p63s23p63d24s2,未成对电子数为2。A.最外层电子数相等,错误;B.Ca的未成对电子数小于Ti,正确;C.同一周期元素,原子序数小的原子半径大,原子半径Ca原子略大,错误;D.Ca原子失去两个电子后恰好达到全满结构,很难失去第三个电子,第三电离能Ca较大,错误,故答案为:B;
(2)①同种类型晶体的熔沸点高低取决于微粒间作用力的大小,H2O2分子间存在氢键,熔沸点高,故答案为:H2O2分子间存在氢键;
②根据价层电子对互斥理论,O3分子的中心O原子的价层电子对为2+![]() (6-2×2)=3,杂化形式为sp2,O3分子为V形结构,分子中正负电荷重心不重合,为极性分子,故答案为:sp2;O3分子为V形结构(或O3分子中正负电荷重心不重合);
(6-2×2)=3,杂化形式为sp2,O3分子为V形结构,分子中正负电荷重心不重合,为极性分子,故答案为:sp2;O3分子为V形结构(或O3分子中正负电荷重心不重合);
(3)①Na2O属于离子化合物,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
②在方法Ⅱ的反应中,形成的化学键有Na3OCl中Na与O、Na与Cl间的离子键,H2分子内有H与H间的非极性键,故答案为:BE;
(4)①Na3OCl晶体结构中空心白球类原子6×![]() =3、顶点阴影球类原子8×
=3、顶点阴影球类原子8×![]() =1、实心黑球类原子1×1=1,根据Na3OCl化学式,可判断钠原子应为空心白球,处在晶体结构的面心,两个钠原子之间的最短距离为晶体结构中两个面心的距离,即为一半边长的
=1、实心黑球类原子1×1=1,根据Na3OCl化学式,可判断钠原子应为空心白球,处在晶体结构的面心,两个钠原子之间的最短距离为晶体结构中两个面心的距离,即为一半边长的![]() 倍,即
倍,即![]() a nm,故答案为:面心;
a nm,故答案为:面心;![]() a;
a;
②已知:晶胞参数为anm,密度为dgcm-3,则dgcm-3=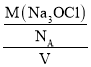 =
=![]() ,解得:NA=
,解得:NA=![]() ,故答案为:
,故答案为:![]() 。
。

【题目】核电站遭破坏,会造成放射性物质![]() I和
I和![]() Cs向外界泄漏。下列有关说法错误的是( )
Cs向外界泄漏。下列有关说法错误的是( )
A.每个![]() Cs含有78个中子
Cs含有78个中子
B.CsOH的碱性比KOH的强
C.HI的还原性比HF的强
D.KIO3是碘的最高价含氧酸的盐
【题目】A~F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示。
元素 | 原子结构或性质 |
A | 原子最外层电子数是内层电子总数的1/5 |
B | 形成化合物种类最多的元素,其单质为固体 |
C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
D | 地壳中含量最多的元素 |
E | 与D同主族 |
F | 与E同周期,且最外层电子数等于电子层数 |
请回答下列问题:(用对应的化学用语回答)
(1)B在元素周期表中的位置是__________;用电子式表示A和E形成的化合物的形成过程 。
(2)A、 D 、E、 F离子半径由大到小的顺序为________________________________。
(3)C的某种氯化物的浓溶液可以腐蚀印刷电路板上的金属铜,此反应的离子方程式是__________________;
(4)B的单质与D的氢化物在一定条件下反应生成BD和另一产物的化学方程式是____________________。该反应为 反应。(填“吸热”或“放热”)
(5)F的最高价氧化物与E的最高价氧化物的水化物反应的离子方程式为 。
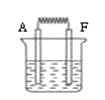
(6)如图:将A和F的单质与烧碱液构成原电池,负极的电极反应式为 ;外电路中电子从 电极流向 电极 。
【题目】下列为元素周期表中的一部分,用化学式或元素符号回答下列问题。
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ⑦ | ||||||
3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
4 | ② | ④ | ⑨ |
(1)11种元素中,化学性质最不活泼的是_____。非金属性最强的元素的原子结构示意图为______。
(2)①②⑤中,最高价氧化物的水化物,碱性最强的是___________。
(3)②③④的原子半径由大到小的顺序是_________。
(4)元素⑦的氢化物常温下和元素②的单质反应的子方程式是________。
(5)⑧的最高价氧化物对应的水化物化学式为__________。
(6)①、⑥和⑦形成的化合物的化学式为______。该化合物的化学键类型为_________。
(7)⑧⑨三种元素形成的气态氢化物最稳定的是_______。
(8)①和⑤最高价氧化物对应的水化物相互反应的化学方程式为________。
(9)下列可以判断①和⑤金属性强弱的是_______________。
a. ①单质的熔点比⑤单质低
b. ①质软,氧化物种类比⑤多
c. ①单质与水反应,⑤单质几乎不与水反应
d. ①最高价氧化物的水化物的碱性比⑤强