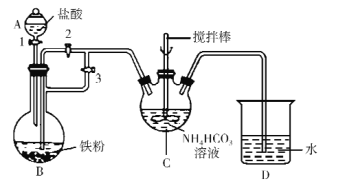
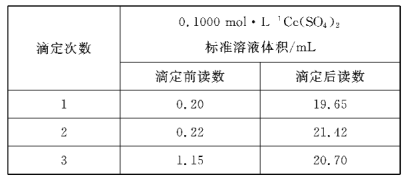
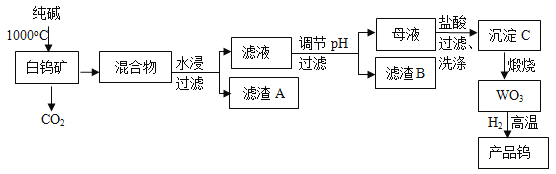
题目内容
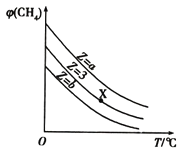
【题目】室温下,用0.100molL﹣1 NaOH溶液分别滴定20.00mL 0.100molL﹣1的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是( )
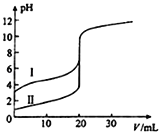
A. Ⅱ表示的是滴定醋酸的曲线
B. V(NaOH)=20.00mL时,两份溶液中c(Cl﹣)=c(CH3COO﹣)
C. pH=7时,滴定醋酸消耗的V(NaOH)小于20mL
D. V(NaOH)=10.00mL时,醋酸溶液中c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
【答案】C
【解析】
A. 0.100mol·L-1的HCl溶液和醋酸溶液,醋酸属于弱酸,存在电离平衡,所以起点pH较小的Ⅱ表示的是滴定盐酸的曲线,故A错误;
B. V(NaOH)= 20.00mL时,酸碱恰好完全反应,因为CH3COO-水解而消耗,所以两份溶液中c(Cl-)>c(CH3COO-),故B错误;
C. 当醋酸与氢氧化钠恰好完全反应时,形成醋酸钠溶液,醋酸钠水解使溶液pH>7,所以pH =7时,滴定醋酸消耗的V(NaOH)<20.00mL,故C正确;
D. V(NaOH)=10.00mL时,生成的醋酸钠与剩余醋酸浓度相等,由于醋酸的电离程度大于醋酸钠的水解程度,所以溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故D错误。
故选C。

【题目】化学反应的ΔH等于反应物的总键能与生成物的总键能之差。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),该反应的反应热ΔH为( )
Si(s)+4HCl(g),该反应的反应热ΔH为( )
A. +412 kJ·mol-1B. -412 kJ·mol-1C. +236 kJ·mol-1D. -236 kJ·mol-1