题目内容
4.2mol/L的盐酸100mL和过量的锌片反应,为了加大反应速率,又不影响生成氢气的总量,可采用的方法是( )| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
分析 过量的锌片,盐酸完全反应,则加快反应速率又不影响生成氢气的总量,可增大氢离子浓度或增大金属的接触面积、构成原电池等,不改变其氢离子物质的量即可,以此来解答.
解答 解:A.加入适量蒸馏水,浓度变小,反应速率减慢,故A错误;
B.如加入固体,则溶液浓度不变,反应速率不变,如加入氯化钠溶液,溶液体积增大,浓度减小,反应速率减小,故B错误;
C.加入适量的6 mol•L-1的盐酸,反应速率加快,生成氢气增多,故C错误;
D.加入数滴氯化铜溶液,锌置换出铜,形成原电池反应,反应速率增大,生成氢气的量不变,故D正确.
故选D.
点评 本题考查影响化学反应速率的因素,注意把握浓度、接触面积对反应速率的影响即可解答,注重基础知识的考查,注意Zn过量盐酸完全反应,题目难度不大.

练习册系列答案
 全能测控一本好卷系列答案
全能测控一本好卷系列答案
相关题目
15.下列各组性质的比较中正确的是( )
| A. | 酸性:HClO4<HBrO4 | B. | 碱性强弱:NaOH>LiOH | ||
| C. | 稳定性:H2S>H2O | D. | 氧化性:I2>Br2>Cl2 |
12.下列说法正确的是(NA表示阿伏加德罗常数的值)( )
| A. | 在常温常压下,1 mol 氖气含有的原子数为2 NA | |
| B. | 1 mol Na2O2中含有O22-数目为NA | |
| C. | 1 mol/L的NaCl溶液中Na+数为NA | |
| D. | 在同温同压下,相同体积的任何气体单质所含的原子数相同 |
19.图所示装置中,已知电子由b极沿导线流向锌.下列判断正确的是( )
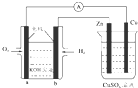

| A. | 该装置中Zn极为阳极 | |
| B. | 一段时间后铜片上质量增加 | |
| C. | a极反应的电极反应式为:O2+4e-+2H2O═4OH- | |
| D. | 当铜极的质量变化为32g时,b极上消耗的O2的体积为11.2 L |
9.下列有关说法正确的是( )
| A. | H与D互为同位素;葡萄糖和蔗糖互为同系物 | |
| B. | 乙烷气体中混有乙烯,通入酸性高锰酸钾溶液,从而除去乙烯 | |
| C. | 元素周期表中从IIIB族到IIB族 10个纵行的元素都是金属元素 | |
| D. | 证明CH3CH2CH=CHCH2CH2OH分子中有碳碳不饱和键的方法:向其中加酸性高锰酸钾溶液,高锰酸钾溶液褪色 |
16.通过下列方法测定1.80g金属Sn样品的纯度.
①将样品溶于盐酸:Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3溶液:SnCl2+2FeCl3═SnCl4+2FeCl2;
③再用酸性KMnO4反应生成的Fe2+,用去0.1000mol/L的KMnO4溶液60.00mL,反应的离子方程式为:MnO4-+
5Fe2++8H+═Mn2++5Fe3++4H2O.
计算金属Sn样品的纯度为( )
①将样品溶于盐酸:Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3溶液:SnCl2+2FeCl3═SnCl4+2FeCl2;
③再用酸性KMnO4反应生成的Fe2+,用去0.1000mol/L的KMnO4溶液60.00mL,反应的离子方程式为:MnO4-+
5Fe2++8H+═Mn2++5Fe3++4H2O.
计算金属Sn样品的纯度为( )
| A. | 99.2% | B. | 49.6% | C. | 96.2% | D. | 46.6% |
13.下列排列顺序中,错误的是( )
| A. | 原子半径:O<S<Na | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 电负性:P<S<Cl | D. | 第一电离能:Na<Al<Mg |
