题目内容
16.通过下列方法测定1.80g金属Sn样品的纯度.①将样品溶于盐酸:Sn+2HCl═SnCl2+H2↑;
②加过量FeCl3溶液:SnCl2+2FeCl3═SnCl4+2FeCl2;
③再用酸性KMnO4反应生成的Fe2+,用去0.1000mol/L的KMnO4溶液60.00mL,反应的离子方程式为:MnO4-+
5Fe2++8H+═Mn2++5Fe3++4H2O.
计算金属Sn样品的纯度为( )
| A. | 99.2% | B. | 49.6% | C. | 96.2% | D. | 46.6% |
分析 根据n=cV计算反应中消耗的KMnO4的物质的量,根据方程式可得关系式:5Sn~5SnCl2~10FeCl3~10FeCl2~2KMnO4,据此计算n(Sn),再根据m=nM计算m(Sn),利用质量分数定义计算试样中Sn的百分含量.
解答 解:反应中消耗的KMnO4的物质的量为0.100mol/L×0.060L=6×10-3mol,
根据方程式可得关系式:5Sn~5SnCl2~10FeCl3~10FeCl2~2KMnO4,
故n(Sn)=$\frac{5}{2}$n(KMnO4)=$\frac{5}{2}$×6×10-3mol=1.5×10-2mol,
Sn的质量为:1.5×10-2mol×119g/mol=1.785g,
试样中Sn的百分含量为$\frac{1.785g}{1.8g}$×100%=99.2%,
故选A.
点评 本题考查氧化还原反应滴定的计算,难度中等,注意利用关系式进行计算.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
6.以下四种有机物的分子式皆为C4H10O:其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
① ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③ ④
④
①
 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③ ④
④
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
7.瘦肉精学名盐酸克伦特罗,其结构简式如图,有关瘦肉精的说法不正确的是( )


| A. | 化学式为C12H18ON2Cl2 | |
| B. | 可以发生取代、加成、水解、酯化、消去反应 | |
| C. | 属于芳香族化合物 | |
| D. | 遇FeCl3溶液发生显色反应 |
4.2mol/L的盐酸100mL和过量的锌片反应,为了加大反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
11.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的质量增加了8.1g,则此反应的反应速率v(X)可表示为( )
| A. | v(NH3)=0.010 mol/( L•s) | B. | v(O2)=0.001 mol/( L•s) | ||
| C. | v(NO)=0.001 mol/( L•s) | D. | v(H2O)=0.045 mol/( L•s) |
1.已知Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=9.1×10-6,Ksp(Ag2SO4)=1.4×10-5.某溶液中含有Ba2+、Ca2+和Ag+的浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的Na2SO4溶液时,三种阳离子产生沉淀的先后顺序为( )
| A. | Ba2+、Ca2+、Ag+ | B. | Ba2+、Ag+、Ca2+ | C. | Ag+、Ba2+、Ca2+ | D. | Ag+、Ca2+、Ba2+ |
8.1-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下: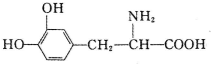
下列关于L-多巴性质的叙述.正确的是( )

下列关于L-多巴性质的叙述.正确的是( )
| A. | 常温下,不溶于水 | B. | 既可与酸反应,又可与碱反应 | ||
| C. | 遇FeCl3溶液无变化 | D. | 与溴水混合,溴水褪色,溶液分两层 |
5.下列关于化学用语的表示正确的是( )
| A. | 乙炔的结构简式:C2H2 | B. | 硫离子结构示意图: | ||
| C. | CaF2的电子式: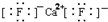 | D. | 中子数为10的氧原子:${\;}_8^{10}$O |