题目内容
7.X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大,X是所有元素中原子半径最小的,Y有三个能级,且每个能级上的电子数相等,Z原子单电子数在同周期元素中最多,W与Z同周期,第一电离能比Z的低,R与Y同一主族,Q的最外层只有一个电子,其他电子层电子均处于饱和状态.请回答下列问题:(1)R核外电子排布式为1s22s22p63s23p2.
(2)X、Y、Z、W形成的有机物YW(ZX2)2中Y、Z的杂化轨道类型分别为sp2、sp3,ZW3-离子的立体构型是平面三角形.
(3)Y、R的最高价氧化物的沸点较高的是SiO2(填化学式),原因是SiO2为原子晶体,CO2为分子晶体.
(4)将Q单质的粉末加入到ZX3的浓溶液中,并通入W2,充分反应后溶液呈深蓝色,该反应的离子方程式为2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-.
分析 X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,则X为H元素;Y有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故Y为C元素;R与Y同一主族,结合原子序数可知,R为Si,而Z原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于Si,故Z为N元素;W与Z同周期,第一电离能比Z的低,则W为O元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,原子序数小于30,故核外电子排布为1s22s22p63s23p63d104s1,则Q为Cu元素,据此解答.
解答 解:X、Y、Z、W、R、Q为前30号元素,且原子序数依次增大.X是所有元素中原子半径最小的,则X为H元素;Y有三个能级,且每个能级上的电子数相等,核外电子排布为1s22s22p2,故Y为C元素;R与Y同一主族,结合原子序数可知,R为Si,而Z原子单电子数在同周期元素中最多,则外围电子排布为ns2np3,原子序数小于Si,故Z为N元素;W与Z同周期,第一电离能比Z的低,则W为O元素;Q的最外层只有一个电子,其他电子层电子均处于饱和状态,不可能为短周期元素,原子序数小于30,故核外电子排布为1s22s22p63s23p63d104s1,则Q为Cu元素,
(1)R为Si,核外电子排布式为:1s22s22p63s23p2,故答案为:1s22s22p63s23p2;
(2)H、C、N、O形成的有机物CO(NH2)2,分子中C原子形成3个σ键,没有孤电子对,C原子采取sp2杂化,N原子形成3个σ键,含有1对孤电子对,N原子采取sp3杂化;
NO3-离子中N原子孤电子对数为$\frac{5+1-2×3}{2}$=0、价层电子对数为3+0=3,故其立体构型是平面三角形,
故答案为:sp2、sp3;平面三角形;
(3)Y、R的最高价氧化物分别为二氧化碳、二氧化硅,SiO2为原子晶体,CO2为分子晶体,故沸点较高的是 SiO2,
故答案为:SiO2; SiO2为原子晶体,CO2为分子晶体;
(4)将Cu单质的粉末加入到NH3的浓溶液中,并通入O2,充分反应后溶液呈深蓝色,反应生成[Cu(NH3)4]2+,该反应的离子方程式为:2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-,
故答案为:2Cu+8NH3+O2+2H2O=2[Cu(NH3)4]2++4OH-.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化轨道、分子构型、晶体类型与性质、配合物等,需要学生具备扎实的基础,难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
| A. | 乙炔的结构简式:C2H2 | B. | 硫离子结构示意图: | ||
| C. | CaF2的电子式: | D. | 中子数为10的氧原子:${\;}_8^{10}$O |
| A. | 淀粉 聚异戊二烯 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 纤维素 涤纶 |

| A. | 酸与碱的中和反应 | |
| B. | 镁与盐酸的反应 | |
| C. | Ba(OH)2•8H2O与NH4Cl两种晶体混合搅拌 | |
| D. | 葡萄糖在生物体内氧化生成CO2 |
| A. | 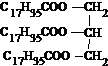 属于酯类 属于酯类 | B. | 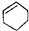 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 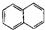 属于脂环化合物 属于脂环化合物 | D. | 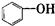 属于芳香烃 属于芳香烃 |
(2 ) 有A、B、C、D四种金属,已知用B与C相连作电极放入硫酸铜溶液中C的质量增加.B与A相连插入稀硫酸时A不断溶解.按下表中装置进行实验,根据实验现象填表:
| 装置 | 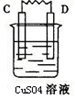 | 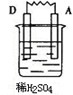 |
| 现象 | 电子流入C极 | A上有气体产生 |
| 正极反应式 | ||
| 四种金属由弱到强顺序 | ||
A SO2 与SO3浓度相等时 B 气体的密度恒定时 C 2V正(O2 )=V逆(SO3)