题目内容
13.下列排列顺序中,错误的是( )| A. | 原子半径:O<S<Na | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 电负性:P<S<Cl | D. | 第一电离能:Na<Al<Mg |
分析 A.同周期元素原子半径依次减小,同主族从上到下依次增大;
B.元素的非金属性越强,其气氢化物的热稳定性越强;
C.元素的非金属性越强,电负性越强;
D.同一周期元素的第一电离能随着原子序数的增大而增大,注意同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的.
解答 解:A.同周期元素原子半径依次减小,同主族从上到下依次增大,所以半径:O<S<Na,故A正确;
B.元素的非金属性越强,其气氢化物的热稳定性越强,非金属性:N>S>P,所以稳定性PH3<H2S<NH3,故B错误;
C.元素的非金属性越强,电负性越强,元素的非金属性:P<S<Cl,所以电负性P<S<Cl,故C正确;
D.同一周期元素的第一电离能随着原子序数的增大而增大,同一周期的第ⅡA元素的第一电离能大于第ⅢA族的,第ⅤA族的大于第ⅥA族的,所以第一电离能Na<Al<Mg,故D正确;
故选B.
点评 本题考查了元素金属性、非金属性的判断依据、元素性质的递变规律,题目难度小属于基础题,注意理解并记住相应的递变规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.下列物质中,N元素的化合价为+5的是( )
| A. | N2 | B. | HNO3 | C. | N2O4 | D. | NH4Cl |
4.2mol/L的盐酸100mL和过量的锌片反应,为了加大反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
1.已知Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=9.1×10-6,Ksp(Ag2SO4)=1.4×10-5.某溶液中含有Ba2+、Ca2+和Ag+的浓度均为0.01mol/L,向该溶液中逐滴加入0.01mol/L的Na2SO4溶液时,三种阳离子产生沉淀的先后顺序为( )
| A. | Ba2+、Ca2+、Ag+ | B. | Ba2+、Ag+、Ca2+ | C. | Ag+、Ba2+、Ca2+ | D. | Ag+、Ca2+、Ba2+ |
8.1-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下: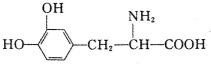
下列关于L-多巴性质的叙述.正确的是( )

下列关于L-多巴性质的叙述.正确的是( )
| A. | 常温下,不溶于水 | B. | 既可与酸反应,又可与碱反应 | ||
| C. | 遇FeCl3溶液无变化 | D. | 与溴水混合,溴水褪色,溶液分两层 |
5.下列关于化学用语的表示正确的是( )
| A. | 乙炔的结构简式:C2H2 | B. | 硫离子结构示意图: | ||
| C. | CaF2的电子式: | D. | 中子数为10的氧原子:${\;}_8^{10}$O |
2.化学合成技术对人类健康水平和生活质量的提高做出了巨大贡献.下列各组物质全部为合成高分子材料的是( )
| A. | 淀粉 聚异戊二烯 | B. | 麦芽糖 胰岛素 | ||
| C. | 聚乙烯 酚醛树脂 | D. | 纤维素 涤纶 |
16.有关物质的分类,下列说法正确的是( )
| A. | 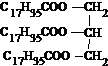 属于酯类 属于酯类 | B. | 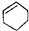 属于芳香族化合物 属于芳香族化合物 | ||
| C. | 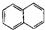 属于脂环化合物 属于脂环化合物 | D. | 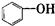 属于芳香烃 属于芳香烃 |