题目内容
15.下列各组性质的比较中正确的是( )| A. | 酸性:HClO4<HBrO4 | B. | 碱性强弱:NaOH>LiOH | ||
| C. | 稳定性:H2S>H2O | D. | 氧化性:I2>Br2>Cl2 |
分析 A、非金属性越强,最高价氧化物对应水化物的酸性越强;
B、金属性越强,最高价氧化物对应水化物的碱性越强;
C、非金属性越强,对应的氢化物越稳定;
D、元素非金属性越强对应单质的氧化性越强.
解答 解:A、Cl、Br位于同一主族,同主族元素从上到下元素的非金属性逐渐减弱,对应的最高价氧化物的水化物的酸性逐渐减弱,所以酸性:HClO4>HBrO4,故A错误;
B、同主族元素的金属性从上到下逐渐增强,对应的最高价氧化物的水化物的进行逐渐减弱,所以碱性:NaOH>LiOH,故B正确;
C、同主族元素从上到下元素的非金属性逐渐减弱,非金属性:O>S,且非金属性越强,对应的氢化物越稳定,则有稳定性:H2O>H2S,故C错误;
D、元素非金属性越强对应单质的氧化性越强,非金属性:I<Br<Cl,所以单质的氧化性:I2<Br2<Cl2,故D错误;
故选B.
点评 本题考查元素周期表的递变规律,题目难度不大,注意单质、化合物的性质与金属性、非金属性的关系.

练习册系列答案
相关题目
5.下列实验方案能达到目的是( )
| A. | 除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤 | |
| B. | 提取碘水中的碘:加入适量乙醇,振荡、静置、分液 | |
| C. | 提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤 | |
| D. | 除去氮气中混有的氧气:将混合气体通过灼热的铜 |
6.以下四种有机物的分子式皆为C4H10O:其中既能发生消去反应生成相应的烯烃,又能氧化生成相应醛的是( )
① ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③ ④
④
①
 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③ ④
④
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
3.下列物质中,N元素的化合价为+5的是( )
| A. | N2 | B. | HNO3 | C. | N2O4 | D. | NH4Cl |
10.某元素最高价含氧酸的化学式是HRO3,该元素的气态氢化物化学式可表示为( )
| A. | HR | B. | H2R | C. | RH3 | D. | 不能确定 |
20.图是产生和收集气体的实验装置,该装置适合于( )


| A. | 用NH4C1和Ca(OH)2反应制取NH3 | B. | 用浓盐酸和MnO2反应制取C12 | ||
| C. | 用H2O2溶液和MnO2反应制取O2 | D. | 用浓硝酸与Cu反应制取NO2 |
7.瘦肉精学名盐酸克伦特罗,其结构简式如图,有关瘦肉精的说法不正确的是( )


| A. | 化学式为C12H18ON2Cl2 | |
| B. | 可以发生取代、加成、水解、酯化、消去反应 | |
| C. | 属于芳香族化合物 | |
| D. | 遇FeCl3溶液发生显色反应 |
4.2mol/L的盐酸100mL和过量的锌片反应,为了加大反应速率,又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
5.下列关于化学用语的表示正确的是( )
| A. | 乙炔的结构简式:C2H2 | B. | 硫离子结构示意图: | ||
| C. | CaF2的电子式: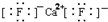 | D. | 中子数为10的氧原子:${\;}_8^{10}$O |