题目内容
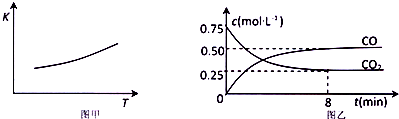
14.一定条件下铁可以和C02发生反应:Fe(s)+C02(g)?FeO(s)+CO(g);已知该反应的平衡常数(K)与温度(T)的关系如图甲所示:
(1)该反应的平衡常数表达式K=$\frac{c(CO)}{c(C{O}_{2})}$.
(2)-定温度下,向某密闭容器中加入足量铁粉并充入一定量的C02气体,反应过程中C02 气体和CO气体的浓度与时间的关系如图乙所示.8分钟内,CO的平均反应速率v(CO)=0.0625mol•L-1•min-1.
(3)在恒容密闭容器发生反应,下列措施中能加快反应速率的是ABC,能使平衡时$\frac{c(CO)}{c(C{O}_{2})}$增大的是A(填序号).
A.升高温度 B.增大压强 C.使用催化剂 D.再加入一些铁粉
(4)铁的重要化合物高铁酸钠是一种新型饮用水消毒剂,具有氧化能力强、安全性好等优点.
①高铁酸钠生产方法之一是电解法,其原理为Fe+2Na0H+2H20$\frac{\underline{\;电解\;}}{\;}$Na2Fe04+3H2↑,则电解时阳极的电极反应式是Fe+8OH--6e-=FeO42-+4H2O.高铁酸钠对饮用水进行消毒后具有净水功能,其净水原理是4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑(用离子方程式表示).
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
分析 (1)根据反应Fe(s)+CO2(g)?FeO(s)+CO(g)中各物质状态及平衡常数表达式写出该反应的平衡常数表达式K;
(2)根据v=$\frac{△c}{△t}$计算8分钟内,CO的平均反应速率v(CO);
(3)根据影响化学反应速率的因素判断;根据反应前后气体的计量数之和关系以及压强对平衡移动的影响分析;
(4)①阳极发生氧化反应,根据反应物和生成物书写电极反应式;高铁酸根离子能发生氧化还原反应生成氧气,同时生成氢氧化铁,氢氧化铁具有吸附性;
②根据氧化还原反应中电荷守恒、电子转移守恒、原子守恒可知另外的化合物含有H元素,应为水,据此写出离子方程式.
解答 解:(1)反应Fe(s)+CO2(g)?FeO(s)+CO(g)中,铁和氧化亚铁为固体,不影响平衡的移动,所以该反应的平衡常数表达式为:K=$\frac{c(CO)}{c(C{O}_{2})}$,
故答案为:$\frac{c(CO)}{c(C{O}_{2})}$;
(2)根据图乙可知,8分钟内一氧化碳的浓度变化为0.5mol/L,所以CO的平均反应速率v(CO)=$\frac{0.5mol/L}{8min}$=0.0625mol/(L•min),
故答案为:0.0625;
(3)该反应中有气体参与,则升高温度、增大压强、使用催化剂都可以加快反应速率,即:ABC正确;
A.该反应正反应为吸热反应,升高温度,平衡向正反应进行,c(CO)增大c(CO2)减小,所以 c(CO)/c(CO2)的值增大,故A正确;
B.该反应反应前后气体的体积不变,增大压强平衡不移动,c(CO)/c(CO2)的值不变,故B错误;
C.恒温恒容,充入一定量氮气,c(CO)、c(CO2)不变,平衡不移动,c(CO)/c(CO2)的值不变,故C错误;
D.铁粉为固体,浓度为定值,增加铁粉的用量,不影响平衡,c(CO)/c(CO2)的值不变,故D错误;
故答案为:ABC;A;
(4)①电解时Fe作阳极,失去电子生成FeO42-,则阳极的电极反应式应为:Fe+8OH--6e-=FeO42-+4H2O;
高铁酸根离子具有强氧化性,所以能杀菌消毒,高铁酸根离子和水反应生成氢氧化铁胶体,胶体具有吸附性,所以能净水,反应方程式为:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑,
故答案为:Fe+8OH--6e-=FeO42-+4H2O;4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑;
②强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,根据电荷守恒、电子转移守恒、原子守恒可知另一种常见化合物含有H元素,应为水,离子方程式为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
故答案为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O.
点评 本题综合性较强,涉及反应速率、平衡影响因素、氧化还原反应、读图提取信息等知识,题目难度中等,试题侧重对学生能力的培养和解题方法的指导与训练,旨在考查学生灵活运用基础知识解决实际问题的能力.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 除去NaCl固体中混有的MgCl2:加入KOH试剂后过滤 | |
| B. | 提取碘水中的碘:加入适量乙醇,振荡、静置、分液 | |
| C. | 提纯混有少量硝酸钾的氯化钾:将混合物溶于热水中,再冷却、结晶并过滤 | |
| D. | 除去氮气中混有的氧气:将混合气体通过灼热的铜 |
| A. | 通入稀硫酸中 | B. | 通入NaOH溶液中 | ||
| C. | 与Cl2混合光照 | D. | 通入酸性KMnO4溶液中 |
| A. | 电解氯化铜溶液的阳极反应式为2Cl--2e-═Cl2↑ | |
| B. | 燃料电池负极加入或通入的物质是助燃物 | |
| C. | 原电池中电子从负极经过溶液流入正极 | |
| D. | 用惰性电极电解硝酸银溶液,一段时间后,溶液酸性增强 |
①
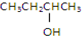 ②CH3CH2CH2CH2OH③
②CH3CH2CH2CH2OH③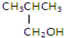 ④
④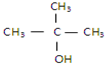
| A. | ①② | B. | 只有② | C. | ②和③ | D. | ③和④ |
| A. | N2 | B. | HNO3 | C. | N2O4 | D. | NH4Cl |
| A. | 加入适量蒸馏水 | B. | 加入适量的氯化钠 | ||
| C. | 加入适量的6mol/L盐酸 | D. | 加入数滴氯化铜溶液 |
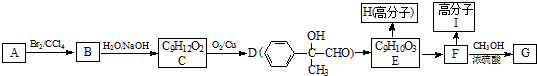
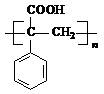 .
. ;②F→G
;②F→G .
. .
.