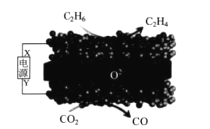
题目内容
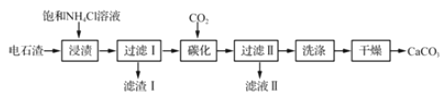
【题目】铝土矿是工业上制备金属铝的主要原料,其主要成分是Al2O3,同时还含有SiO2 和Fe2O3。工业上可使用碱浸法提取铝土矿中的 Al2O3,其工业流程如图所示。根据图示信息,回答下列问题。
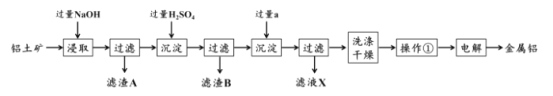
(1)为了提高铝土矿的浸取效率,可采用的方法是:______。
(2)第一次沉淀时发生了一系列离子反应,除了生成固体 B 的反应外,还有另外两个反应,请分别写出它们的离子方程式:_______,______。
(3)液体试剂 a 的化学式为_________。
(4)该工艺的副产品存在于滤液 X 中,除 Na2SO4 外,其主要成分是________ (填化学式)。试列举一项该副产品在工业生产或日常生活中的用途:________。
(5)操作①的名称为____。若在实验室中进行该操作,样品应放置在_______中。
(6)最后一步电解时往往需要加入适量冰晶石,其作用是 __________。
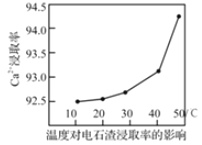
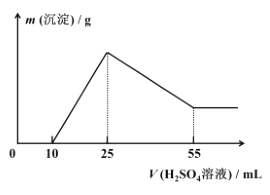
(7)取 10.0 g 铝土矿按照上述工艺进行处理,并在工艺中使用 5.0 mol/L 的稀硫酸。第一次沉淀时所得沉淀的质量与加入硫酸的体积变化关系如图所示。则该铝土矿样品中 Al2O3 的质量分数为 ________。
【答案】①粉碎铝土矿样品,增大接触面积;②浸取时不断搅拌;③浸取时适当升温,加速反应 H+ +OH- = H2O ![]() + 4H+ = Al3+ + 2H2O NH3H2O (NH4)2SO4 氮肥 灼烧 坩埚 降低Al2O3的熔化温度,节约能源 51%
+ 4H+ = Al3+ + 2H2O NH3H2O (NH4)2SO4 氮肥 灼烧 坩埚 降低Al2O3的熔化温度,节约能源 51%
【解析】
铝土矿的主要成分是Al2O3,同时还含有SiO2 和Fe2O3,加入过量的NaOH溶液后,Al2O3、SiO2分别转化为![]() 和
和![]() ,而Fe2O3不溶解,所以滤渣A为Fe2O3;滤液中加入过量的硫酸,
,而Fe2O3不溶解,所以滤渣A为Fe2O3;滤液中加入过量的硫酸,![]() 转化为Al3+,
转化为Al3+,![]() 转化为H2SiO3沉淀,过滤所得滤渣B为H2SiO3沉淀;滤液中加入过量氨水,此时Al3+转化为Al(OH)3沉淀,过滤,所得滤液为Na2SO4、(NH4)2SO4等,滤渣为Al(OH)3,灼烧得Al2O3,熔融电解便可获得Al。
转化为H2SiO3沉淀,过滤所得滤渣B为H2SiO3沉淀;滤液中加入过量氨水,此时Al3+转化为Al(OH)3沉淀,过滤,所得滤液为Na2SO4、(NH4)2SO4等,滤渣为Al(OH)3,灼烧得Al2O3,熔融电解便可获得Al。
(1)为了提高铝土矿的浸取效率,可通过提高温度、增大接触面积的方法,所以可采用的方法是:①粉碎铝土矿样品,增大接触面积;②浸取时不断搅拌;③浸取时适当升温,加速反应。答案为:①粉碎铝土矿样品,增大接触面积;②浸取时不断搅拌;③浸取时适当升温,加速反应;
(2)第一次沉淀时,加入过量的硫酸,![]() 转化为Al3+,
转化为Al3+,![]() 转化为H2SiO3沉淀,同时前面加入的过量NaOH也会与硫酸发生反应,它们的离子方程式:H+ +OH- = H2O,
转化为H2SiO3沉淀,同时前面加入的过量NaOH也会与硫酸发生反应,它们的离子方程式:H+ +OH- = H2O,![]() + 4H+ = Al3+ + 2H2O。答案为:H+ +OH- = H2O;
+ 4H+ = Al3+ + 2H2O。答案为:H+ +OH- = H2O;![]() + 4H+ = Al3+ + 2H2O;
+ 4H+ = Al3+ + 2H2O;
(3)为了将Al3+转化为Al(OH)3沉淀,需加入氨水,所以液体试剂 a 的化学式为NH3H2O。答案为:NH3H2O;
(4)由以上分析可知,该工艺的副产品存在于滤液 X 中,除 Na2SO4 外,其主要成分是(NH4)2SO4。该副产品在工业生产或日常生活中常被用作化肥,所以其用途是:氮肥。答案为:(NH4)2SO4;氮肥;
(5)操作①是将Al(OH)3转化为Al2O3,其名称为灼烧。若在实验室中进行该操作,样品应放置在坩埚中。答案为:灼烧;坩埚;
(6)Al2O3的熔点很高,为降低其熔化温度,最后一步电解时往往需要加入适量冰晶石,其作用是降低Al2O3的熔化温度,节约能源。答案为:降低Al2O3的熔化温度,节约能源;
(7)从图中可以看出,加入硫酸的体积由25mL至55mL段,主要发生反应3H2SO4+2Al(OH)3=Al2(SO4)3+6H2O,则参加反应的硫酸物质的量为n(H2SO4)= 5.0 mol/L×0.03L=0.15mol,n[Al(OH)3]= ![]() =0.10mol,则该铝土矿样品中 Al2O3 的质量分数为
=0.10mol,则该铝土矿样品中 Al2O3 的质量分数为![]() =51%
=51%

 考前必练系列答案
考前必练系列答案