题目内容
将H2(g)和Br2(g)充入恒容密闭容器中,恒温下发生反应H2(g)+Br2(g)  2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
2HBr(g) (正反应放热),平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。 a与b的关系是
| A.a>b | B.a =b | C.a <b | D.无法确定 |
A
解析试题分析:恒温条件下反应是放热反应,平衡时Br2(g)的转化率为a,若初始条件相同,绝热下进行上述反应,由于反应是放热反应,容器中的温度高于恒温条件下容器中的温度,平衡向吸热反应方向移动,所以平衡逆向进行,平衡时Br2(g)的转化率小于a,即a>b,答案选A。
考点:考查外界条件对平衡状态的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题针对性强,旨在培养学生灵活运用基础性知识解决实际问题的能力的培养。该题的关键是理解恒温容器和绝热容器的本质区别。

练习册系列答案
 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案
相关题目
已知反应A(g)+3B(g)  2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
2C(g)+D(g),在某段时间内,以A的浓度变化表示的反应速率为2 mol/(L·s),则以C的浓度变化表示的反应速率为
| A.1 mol/(L·s) | B.3 mol/(L·s) |
| C.4 tool/(L·s) | D.2 mol/(L·s) |
下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是
| A.10℃ 20mL 3mol/L的盐酸溶液 | B.20℃ 30mL 2mol/L的盐酸溶液 |
| C.20℃ 20mL 2mol/L的盐酸溶液 | D.20℃ 10mL 4mol/L的盐酸溶液 |
在一定温度下,下列叙述说明可逆反应A(g)+2B(g)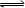
 2C(g) 达到平衡的( )
2C(g) 达到平衡的( )
A.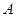 、 、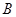 、 、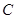 的浓度之比为1:2:2 的浓度之比为1:2:2 |
B.单位时间内消耗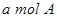 ,同时生成2a mol C ,同时生成2a mol C |
C.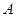 的浓度不再变化 的浓度不再变化 |
| D.混合气体总物质的量为2a mol |
下图是可逆反应X2+3Y2 2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率(v)与时间(t)的关系曲线,下列叙述正确的是
| A.t1时,只有正方向反应 | B.t1~t2时,X2的物质的量越来越多 |
| C.t2~t3,反应不再发生 | D.t2~t3,各物质的浓度不再发生变化 |
在一定温度下,可逆反应X(g)+3Y(g) 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
| A.Z生成的速率与X生成的速率相等 |
| B.单位时间生成a mol X,同时生成3a mol Y |
| C.X、Y、Z的浓度不再变化 |
| D.X、Y、Z的分子数比为1∶3∶2 |
将4 mol A气体和2mol B气体在2 L的密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g) 2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是( )
2C(g),反应2 s后测得C的物质的量为1.2mol。下列说法正确的是( )
| A.用物质B表示2s内的平均反应速率为0.6 mol/(L·s) |
| B.用物质A表示2 s内的平均反应速率为0.3 mol/(L·s) |
| C.2 s后物质A的转化率为70% |
| D.2 s后物质B的浓度为0.35 mol/L |
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
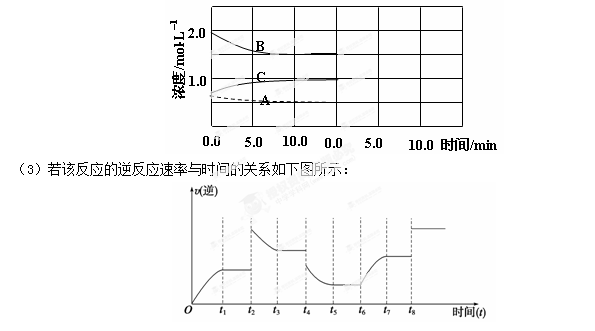
 2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题:
2NH3(g) △H<0。在等容条件下进行。体系中各物质浓度随时间变化的曲线如图所示,回答问题: